简介
凝胶过滤层析(gel filtration chromatography ) 又称分子筛层析(molecular sieve chromatography ) 或排阻层析(exclusion chromatography), 是按照分子的大小来分离蛋白质的方法。
原理
凝胶过滤层析法测定蛋白质相对分子量的基本原理是按照蛋白质的分子大小和形状分离不同的蛋白质,因此可以以分子最标准品为参照,测定样品蛋白质的相对分子量。
材料与仪器
步骤
凝胶过滤层析法测定蛋白质相对分子量基本过程可分为如下几步:
A. 蛋白质分子在凝胶过滤柱层析中的行为以洗脱体积(elution volume, Ve)伎俩。凡是自加入样品起,到组分洗脱达最高峰时所流出的体积。将标准品的洗脱体积对相应分子量作图,获得的标准曲线可以用来求出待测样品的分子量。Ve 与分子量的关系可以表示为:
Ve = K1 - K2IogMr
式中 K1 和 K2 为常数, Mr 为相对分子量,Ve 为洗脱体积。
在用凝胶过滤柱层析法测定分子量时,根据待测样品的分子量选择适宜的凝胶过滤基质, 最常用的是葡聚糖凝胶。将基质装柱,方法见附录 Ⅲ。
B. 依次将标准品(可以是几种不同分子量标准品的混合液)和待测样品进行层析分析。在不影响黏度的前提下,尽擞使用较高的样品浓度,体积应该控制在柱床体积的 1%-2% 。加样和洗脱的方法与一般层析法相同,即在柱床表面液体刚刚流入凝胶后,轻轻将样品加到柱床表面,不要破坏柱床表面的平整,以免导致洗脱峰的分散。待样品流入柱床后, 加入洗脱液开始洗脱。
C. 若要监测标准品或待测样品的洗脱情况,可以将流出液直接连接到紫外分光光度计, 后者可以连续读出流出液的 A280, 并在记录仪上记录下来(图 10-3 )。洗脱完成后,可以根据记录下来的洗脱峰位置、流速及记录纸走纸速度计算出每一个样品的 Ve。国产的核酸蛋白检测仪基本上可以满足这一需要。
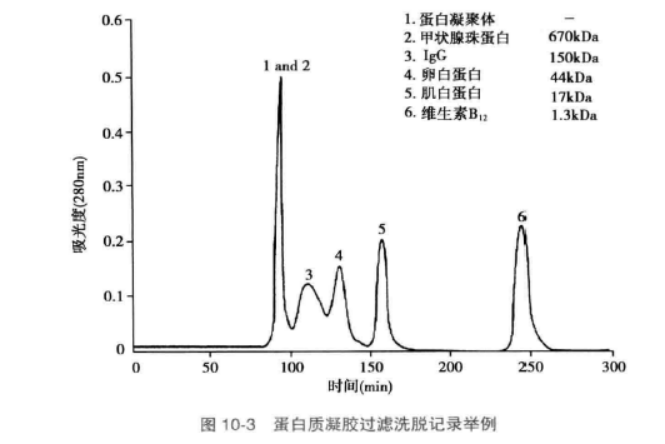
如没有相应的仪器,也可以分部收集流出液(如每管3ml), 再用紫外分光光度计测定各管的
A280, 计算出 Ve
D.完成 Ve 测定后,以蛋白质分子量的对数为横坐标,Ve 为纵坐标,作出标准曲线。根据标准曲线计算出待测样品的分子量。
注意事项
1. 在层析过程中的任何时候,液面都不能低于柱床表面,否则可能会进入气泡影响样品的洗脱行为。
2. 葡聚糖凝胶一旦溶胀装柱,在使用过程中应始终保待在液体中,如果凝胶暴露千空气而干燥,凝胶的结构就会被破坏,影响分离效果。
3. 由千葡聚糖凝胶为糖类化合物,要特别注意防止发生细菌或霉菌的污染。一般在完成层析后,要将柱床用水洗脱干净,并在最后的洗脱液中加入 0.02% 的叠氮钠作为防腐剂。也可以逐渐提高洗脱液中的乙醇浓度直至 95%, 使凝胶脱水收缩,再用乙酪洗去乙醇,抽滤干燥后保存。
来源:丁香实验







