双向电泳前去垢剂和离液剂对蛋白质的增溶作用
丁香园
3977
1. 前言
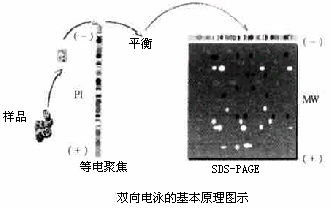
以双向电泳为基础的蛋白质组学研究中,蛋白质的溶解是一项艰巨的任务。举例来说 ,蛋白质必须达到它们的 pI,并且在这个 pI 保持可溶性,pI 也是溶解度的最低限度。此外,当蛋白质接近它们的 pI 值时,蛋白质的流动性下降,在强烈的电场中 ( 200 V/cm,与用于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 10~20 V/cm 相比并不罕见)蛋白质进行等电聚焦(IEF) 。反过来意味,一般的盐类和离子化合物在 IEF 中几乎被排除。此外,在 IEF 之前使用的任何溶剂,不得改变蛋白质原有的 pI。因此,这排除了使用强离子去垢剂如 SDS。然而,少量的[ 0.03% ( m/V ) 以内] 离子去垢剂还是可以用,提供 SDS 与其他非离子去垢剂相互交换的条件,这确保去除了与蛋白质紧密结合的 SDS,但在等电聚焦过程中 SDS 的用处也损失了。因此,建议在 IEF 之前蛋白样品彻底溶解之后作用 SDS。
抛开这些由于蛋白质自身性质而产生的问题不说,许多生物样品中存在的问题源于样品中存在的非蛋白类化合物。典型的例子是,核酸浓度过高时完全模糊了双向电泳图谱 [4] 。核酸在低离子强度的 IEF 中起着移动离子交换的作用从而造成假象。其他类别的化合物(脂类,盐等)也会在蛋白样品电泳图谱中产生假象。尤其是植物样品,因为植物组织能合成一系列具有不同结构的化合物。举例来说,在一些植物组织中酚类物质和叶绿素是非常丰富的,在蛋白质组学技术中有时能完全破坏蛋白质的分离提取。
因此根据初始材料的不同存在不同的问题。当从整个组织开始时,普遍面临的主要问题是非蛋白化合物所产生的干扰。这些方面将在本书的其他章节描述。本章将侧重于其他方面的问题,如镶嵌蛋白的溶解,和主要解决用于蛋白质初步溶解和 IEF 的离液剂和去垢剂。
如前所述,IEF 中的制约因素限制了化学药品的选择,在 pH 波动范围内样品溶液不能有净电荷产生,如非离子型或两性离子化合物。这限制了酰胺和尿素类离液剂的选择,胍和脒在 pH 12 以下是带电荷的。尿素作为可行的离液剂已经使用了很长一段时间了。最近,加入硫脲的尿素离液剂不仅增加蛋白溶解性 [5] 但而且还限制蛋白酶活性 [6] 。在溶解过程中离液剂的作用是打破样品中的各种分子非共价的相互作用(如氢键,偶极-偶极的相互作用,以及疏水相互作用)并且使蛋白质展开。虽然离子键不受非离子型离液剂如尿素和硫脲直接影响,这些离液剂对水的电容率的影响也改变离子键的强度。
去垢剂方面,不带电荷的去垢剂的效率比离子的显然少得多,这是很清楚的。离子去垢剂,使蛋白质分子穿了一件带电「 外套」,从而使蛋白质-去垢剂复合物通过离子相互排斥,从而防止蛋白的聚集。然而离子去垢剂不能用于 IEF 的二向分离。不过,它们可以用在分区电泳方法中,本章将会给出一个简短的例子。
广泛的商业非带电去垢剂的选择中,共有两个亚类。非离子型去垢剂分子不带电荷,而两性离子去垢剂分子上有同等数量的正负电荷。根据分子的可电离基团 pK,一些去垢剂可以在一定的 pH 范围内离子化(其中至少有一个基团被滴定)在另一 pH 范围内两性离子化,而其他去垢剂则在完整的 pH 范围才被两性离子化。举一个说明两种情况的例子,当羧酸基团没有充分去质子化,甜菜碱(带有四铵盐和羧酸基团)在低 pH 下会带上正电荷;当羧酸基团完全被去质子化后,如超过 PK 2 pH 单位以上,它们即成为一个两性离子去垢剂。相比之下,磺基甜菜碱,带有四铵盐和磺酸基团,在 0~14 的 pH 范围是两性离子,因为两个基团在这个范围内都电离。事实上,去垢剂只有在 pH 范围内完全电离为两性离子才可用于 IEF。
两种传统用于双向电泳的去垢剂是非离子型去垢剂 Triton X-100 ( 或 NP- 40 ) 和两性离子去垢剂 3 [3-cholaminoproply diethylammonio] -1-propane sulfate (CHAPS ) 。两种去垢剂都已尿素结合广泛使用,但没有被证明在溶解难溶性蛋白质(如膜蛋白)方面非常有效 [7] 。然而,最近的工作表明,无论是特别设计的两性离子去垢剂 [ 8~10 ] ,或精心选择的非离子型去垢剂 [11] 都可以溶解膜蛋白。有趣的是,Triton X-100 只与尿素合用不如与尿素-硫脲合用更有效 [11] 。这个发现已延伸到其他低聚乙二醇去垢剂家族,如 Brij 去垢剂,如线性烷基寡聚乙二醇化合物 [11] 。然而,最有效的非离子型去垢剂属于糖苷家族(如辛基葡萄糖苷、十二烷基麦芽糖苷),而后者在单独与尿素使用 [12] 和与尿素-硫脲使用 [ 11,13] 同样有效。由于不同去垢剂的选择而引起蛋白质溶解多样化的例子见图 12-1。溶解过程中发挥作用的多种变量在参考文献 14 中也有研究。尽管如此,我们并不能因为前文讨论就认为十二烷基麦芽糖苷就是双向电泳中蛋白溶解的最好的去垢剂 。虽然去垢剂的选择取决于蛋白样品自身的特性,但是根据之前的实验结果,还是有些可作为常用去垢剂用于蛋白质溶解,例如十二烷基麦芽糖苷、ASB14、C7B20、Br-ij56 和 C13E10,对于可溶性蛋白,CHAPS 是很好的选择。
2.1 生物材料
拟南芥膜材料根据 Santoni 的方法(见 第 11 章)制备。
2.2 设备
( 1 ) 桌上用超速离心机,用于膜的制备和去除不溶蛋白质。
( 2 ) 固相 pH 梯度胶条 [ 固定 pH 梯度(IPG ),线性和非线性,pH 梯度 3~10,长 18 cm;Amersham Pharmacia Biotech] 。
( 3 ) IPGphor 装置:用于等电聚焦蛋白质(Amersham Pharmacia Biotech) 。
( 4 ) 管胶电泳设备(Bio-Rad ),用于第一向凝胶电泳。
( 5 ) Protean II:用于 SDS-PAGE 电泳(Bio-Rad) 。
2.3 药品和贮存液
( 1 ) 十二烷基麦芽糖苷,Triton X-100 和 CHAPS,最好是用 20% (m/V ) 溶解于水的贮存液。这些贮存液应存放在 4°C 并且标明有限的贮存期(几个星期)。
( 2 ) C13E10、Brij56、ASB14,最好是用由 20% ( m/V ) 的溶解于乙醇/水 [ 50/50 ( V/V ) ] 贮存液。这些贮存液在室温可以稳定贮存数月。
( 3 ) 阳离子去垢剂 [ 十二烷基三甲基溴化铵(DTAB) ,十六烷基三甲基溴化铵 ( CTAB ) ,苯扎氯铵 ] 是用 20% ( m/V ) 的水溶贮存液。这些贮存液在室温下较稳定但是对温度非常敏感。它们有时在使用前需要在 37~40°C 温浴以再溶解去垢剂。
( 4 ) IEF 用的尿素贮存液。在室温下超过 9 mol/L 的尿素是很难溶的,这是在尿素是唯一离液剂的情况下所用的浓度。这表明尿素以固体形式加入(见注释 1) 。
( 5 ) 尿素-硫脲贮存液:离液剂的终浓度是 7 mol/L 尿素和 2 mol/L 硫脲。这意味着配制 1.25 X 浓度的贮存液,比重新为每个样品称取少量的固体尿素和硫脲要简单得多。如果配制 10 ml 这种贮存液,称取 5.25 g 尿素和 1.9 g 硫脲。一些去垢剂(如 CHAPS 或 Triton X-100 ) 是与尿素完全互溶的,可以在这个阶段加入。其他去垢剂与尿素的相容性有限(如 ASB14) ,必须等到溶液最终溶解才加入。必须添加总体积 4.2 ml 的液体到尿素和硫脲,以补足 10 ml ( 见注释 2 和注释 3 ) 。这个溶液可在 -20°C 稳定贮存几个月。
( 6 ) 用于区带电泳的尿素溶液:由于尿素使用时是 4 mol/L 终浓度,因此配成 8 mol/L 的贮存液很方便。配制 10 ml,溶解 4.8 g 尿素在 6.4 ml 的水中。这个贮存液可在 4°C 稳定 2~3 天。
( 7 ) 用于区带电泳的酸性缓冲液:1 mol/L 磷酸二氢钾磷酸盐+1 μl/ml 85% 磷酸。
( 8 ) 三丁基膦(TBP ) 是一种液体(纯的为 4 mol/L ) 。在使用之前在二甲酯甲酰胺中稀释 40 倍,在样品溶液中进一步稀释 50 倍。
( 9 ) 三羧乙基磷酸酯(TCEP ) 是一种固体。用水配制 1 mol/L 贮存液,可在 -20°C 稳定贮存数月。
4. 注释
( 1 ) 尿素所占体积对于确定尿素溶液终浓度很有用。1 g 尿素在溶液中占有 0.75 ml 的体积。对于大多数去垢剂也是如此,1 g 占 1 ml 的体积,这也适用于硫脲。尿素不能加热至 37°C 以上,防止氨甲酰化。例如,1 ml 的液体中加入 900 mg 尿素,就会得到 1.675 ml 含 9 mol/L 尿素的溶液。1 g 尿素添加到 1 ml 液体中,则产生 1.75 ml 的 9.5 mol/L 尿素溶液。
( 2 ) 事实上,大部分的这些提取液含低于 50% 的水。这意味着,固体的溶解是相当困难的,特别是因为不能使用高温( 见前文注释)进行溶解。使用水浴超声仪(用于物品和玻璃器皿)对难溶问题有很大帮助。
( 3 ) 许多去垢剂不能完全与尿素互溶。不溶性的去垢剂-尿素复合物是否会形成,取决于去垢剂的结构和尿素浓度,以及温度。带有直链烷基的去垢剂链特别容易出现这个问题(如 ASB14、Brij56 )。商业直链磺基三甲铵乙内酯不能容纳 4 mol/L 以上浓度的尿素,因此不能使用。
( 4 ) 许多去垢剂强烈干扰一些常用的蛋白质测定方法,而这些方法有时也会受还原物质的干扰(见本书的相关章节),因此有必要把这方面的因素在蛋白质样品溶解过程中考虑进来。在有些情况中,蛋白样品虽然能在各种样品溶液中进行溶解但却总与蛋白检验方法相冲突。在这种情况下,我们建议使用原始蛋白样品进行蛋白浓度检测,特别是蛋白样品是悬浮液的情况。反过来,这也意味着无法评估溶解的效果。
参考文献
1. Weber, K. and Kuter, D. J. (1971) Reversible denaturation of enzymes by sodiumdodecyl sulfate. J. Biol. Chem. 246, 4504-4509.
2. Ames, G. F. L. and Nikaido, K. (1976) Two-dimensional gel electrophoresis ofmembrane proteins. Biochemistry15, 616-623.
3. Remy, R. and Ambard-Bretteville, F. (1987) Two dimensional electrophoresis inthe analysis and preparation of cell organelle polypeptides. Methods Enzymol.148, 623-632.
4. Heizmann, C. W., Arnold, E. M., and Kuenzle, C. C. (1980) Fluctuations of nonhistone chromosomal proteins in differentiating brain cortex and cerebellar neurons. J. Biol. Chem. 255, 11,504-11,511.
5. Rabilloud, T., Adessi, C., Giraudel, A., and Lunardi, J. (1987) Improvement ofthe solubilization of proteins in two-dimensional electrophoresis with immobilized pH gradients. Electrophoresis18, 307-316.
6. Castellanos-Serra, L. and Paz-Lago, D. (2002) Inhibition of unwanted proteolysisduring sample preparation: evaluation of its efficiency in challenge experiments.Electrophoresis 23, VI45-Y153?
7. Santoni, V., Molloy, M., and Rabilloud, T. (2000) Membrane proteins andproteomics: un amour impossible? Electrophoresis 21, 1054-10708 . Chevallet, M., Santoni, V., Poinas, A., et al.(1998) New zwitterionic detergentsimprove the analysis of membrane proteins by two-dimensional electrophoresis.Electrophoresis19,1901-1909.
9 . Rabilloud, T., Blisnick, T., Heller, M., et al. (1999) Analysis of membrane proteins by two-dimensional electrophoresis: comparison of the proteins extractedfrom normal or Plasmodium falciparum-infected erythrocyte ghosts. Electrophoresis 20,36 03-3610
10 . Tastet, C., Charmont, S., Chevallet, M., Luche, S., and Rabilloud, T. (2003) Structure-efficiency relationships of zwitterionic detergents as protein solubilizers intwo-dimensional electrophoresis. Proteomics3, 111-121.
11. Luche, S., Santoni, V., and Rabilloud, T. (2003) Evaluation of nonionic and zwit-terionic detergents as membrane protein solubilizers in two-dimensional electrophoresis. Proteomics3, 249-253.
1 2 . Witzmann, F., Jarnot, B., and Parker, D. (1991) Dodecyl maltoside detergentimproves resolution of hepatic membrane proteins in two-dimensional gels. Electrophoresis 1 2 , 687-688.
13. Taylor, C. M. and Pfeiffer, S. E. (2003) Enhanced resolution of glycosylphos-phatidylinositol-anchored and transmembrane proteins from the lipid-rich myelinmembrane by two-dimensional gel electrophoresis. Proteomics3, 1303-1312.
14 . Santoni, V., Kieffer, S., Desclaux, D., Masson, F., and Rabilloud, T. (2000) Membrane proteomics: use of additive main effects with multiplicative interaction modelto classify plasma membrane proteins according to their solubility and electrophoretic properties. Electrophoresis 21, 3329-3344.
15. Sanchez, J.C., Hochstrasser, D., and Rabilloud, T. (1999) In-gel sample rehydration of immobilized pH gradient. Methods Mol. Biol.11 2 , 221-225.
16. MacFarlane, D.E. (1989) Two dimensional benzyldimethyl-n-hexadecyl-ammonium chloride-sodium dodecyl sulfate preparative polyacrylamide gel electrophoresis: a high capacity high resolution technique for the purification ofproteins from complex mixtures. Anal. Biochem.176,457-463.
17. Hartinger, J., Stenius, K., Hogemann, D., and Jahn, R. (1996) 16-BAC/SDS-PAGE:a two-dimensional gel electrophoresis system suitable for the separation of integralmembrane proteins. Anal. Biochem. 240, 126-133.
以双向电泳为基础的蛋白质组学研究中,蛋白质的溶解是一项艰巨的任务。举例来说 ,蛋白质必须达到它们的 pI,并且在这个 pI 保持可溶性,pI 也是溶解度的最低限度。此外,当蛋白质接近它们的 pI 值时,蛋白质的流动性下降,在强烈的电场中 ( 200 V/cm,与用于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 10~20 V/cm 相比并不罕见)蛋白质进行等电聚焦(IEF) 。反过来意味,一般的盐类和离子化合物在 IEF 中几乎被排除。此外,在 IEF 之前使用的任何溶剂,不得改变蛋白质原有的 pI。因此,这排除了使用强离子去垢剂如 SDS。然而,少量的[ 0.03% ( m/V ) 以内] 离子去垢剂还是可以用,提供 SDS 与其他非离子去垢剂相互交换的条件,这确保去除了与蛋白质紧密结合的 SDS,但在等电聚焦过程中 SDS 的用处也损失了。因此,建议在 IEF 之前蛋白样品彻底溶解之后作用 SDS。
抛开这些由于蛋白质自身性质而产生的问题不说,许多生物样品中存在的问题源于样品中存在的非蛋白类化合物。典型的例子是,核酸浓度过高时完全模糊了双向电泳图谱 [4] 。核酸在低离子强度的 IEF 中起着移动离子交换的作用从而造成假象。其他类别的化合物(脂类,盐等)也会在蛋白样品电泳图谱中产生假象。尤其是植物样品,因为植物组织能合成一系列具有不同结构的化合物。举例来说,在一些植物组织中酚类物质和叶绿素是非常丰富的,在蛋白质组学技术中有时能完全破坏蛋白质的分离提取。
因此根据初始材料的不同存在不同的问题。当从整个组织开始时,普遍面临的主要问题是非蛋白化合物所产生的干扰。这些方面将在本书的其他章节描述。本章将侧重于其他方面的问题,如镶嵌蛋白的溶解,和主要解决用于蛋白质初步溶解和 IEF 的离液剂和去垢剂。
如前所述,IEF 中的制约因素限制了化学药品的选择,在 pH 波动范围内样品溶液不能有净电荷产生,如非离子型或两性离子化合物。这限制了酰胺和尿素类离液剂的选择,胍和脒在 pH 12 以下是带电荷的。尿素作为可行的离液剂已经使用了很长一段时间了。最近,加入硫脲的尿素离液剂不仅增加蛋白溶解性 [5] 但而且还限制蛋白酶活性 [6] 。在溶解过程中离液剂的作用是打破样品中的各种分子非共价的相互作用(如氢键,偶极-偶极的相互作用,以及疏水相互作用)并且使蛋白质展开。虽然离子键不受非离子型离液剂如尿素和硫脲直接影响,这些离液剂对水的电容率的影响也改变离子键的强度。
去垢剂方面,不带电荷的去垢剂的效率比离子的显然少得多,这是很清楚的。离子去垢剂,使蛋白质分子穿了一件带电「 外套」,从而使蛋白质-去垢剂复合物通过离子相互排斥,从而防止蛋白的聚集。然而离子去垢剂不能用于 IEF 的二向分离。不过,它们可以用在分区电泳方法中,本章将会给出一个简短的例子。
广泛的商业非带电去垢剂的选择中,共有两个亚类。非离子型去垢剂分子不带电荷,而两性离子去垢剂分子上有同等数量的正负电荷。根据分子的可电离基团 pK,一些去垢剂可以在一定的 pH 范围内离子化(其中至少有一个基团被滴定)在另一 pH 范围内两性离子化,而其他去垢剂则在完整的 pH 范围才被两性离子化。举一个说明两种情况的例子,当羧酸基团没有充分去质子化,甜菜碱(带有四铵盐和羧酸基团)在低 pH 下会带上正电荷;当羧酸基团完全被去质子化后,如超过 PK 2 pH 单位以上,它们即成为一个两性离子去垢剂。相比之下,磺基甜菜碱,带有四铵盐和磺酸基团,在 0~14 的 pH 范围是两性离子,因为两个基团在这个范围内都电离。事实上,去垢剂只有在 pH 范围内完全电离为两性离子才可用于 IEF。
两种传统用于双向电泳的去垢剂是非离子型去垢剂 Triton X-100 ( 或 NP- 40 ) 和两性离子去垢剂 3 [3-cholaminoproply diethylammonio] -1-propane sulfate (CHAPS ) 。两种去垢剂都已尿素结合广泛使用,但没有被证明在溶解难溶性蛋白质(如膜蛋白)方面非常有效 [7] 。然而,最近的工作表明,无论是特别设计的两性离子去垢剂 [ 8~10 ] ,或精心选择的非离子型去垢剂 [11] 都可以溶解膜蛋白。有趣的是,Triton X-100 只与尿素合用不如与尿素-硫脲合用更有效 [11] 。这个发现已延伸到其他低聚乙二醇去垢剂家族,如 Brij 去垢剂,如线性烷基寡聚乙二醇化合物 [11] 。然而,最有效的非离子型去垢剂属于糖苷家族(如辛基葡萄糖苷、十二烷基麦芽糖苷),而后者在单独与尿素使用 [12] 和与尿素-硫脲使用 [ 11,13] 同样有效。由于不同去垢剂的选择而引起蛋白质溶解多样化的例子见图 12-1。溶解过程中发挥作用的多种变量在参考文献 14 中也有研究。尽管如此,我们并不能因为前文讨论就认为十二烷基麦芽糖苷就是双向电泳中蛋白溶解的最好的去垢剂 。虽然去垢剂的选择取决于蛋白样品自身的特性,但是根据之前的实验结果,还是有些可作为常用去垢剂用于蛋白质溶解,例如十二烷基麦芽糖苷、ASB14、C7B20、Br-ij56 和 C13E10,对于可溶性蛋白,CHAPS 是很好的选择。
2.1 生物材料
拟南芥膜材料根据 Santoni 的方法(见 第 11 章)制备。
2.2 设备
( 1 ) 桌上用超速离心机,用于膜的制备和去除不溶蛋白质。
( 2 ) 固相 pH 梯度胶条 [ 固定 pH 梯度(IPG ),线性和非线性,pH 梯度 3~10,长 18 cm;Amersham Pharmacia Biotech] 。
( 3 ) IPGphor 装置:用于等电聚焦蛋白质(Amersham Pharmacia Biotech) 。
( 4 ) 管胶电泳设备(Bio-Rad ),用于第一向凝胶电泳。
( 5 ) Protean II:用于 SDS-PAGE 电泳(Bio-Rad) 。
2.3 药品和贮存液
( 1 ) 十二烷基麦芽糖苷,Triton X-100 和 CHAPS,最好是用 20% (m/V ) 溶解于水的贮存液。这些贮存液应存放在 4°C 并且标明有限的贮存期(几个星期)。
( 2 ) C13E10、Brij56、ASB14,最好是用由 20% ( m/V ) 的溶解于乙醇/水 [ 50/50 ( V/V ) ] 贮存液。这些贮存液在室温可以稳定贮存数月。
( 3 ) 阳离子去垢剂 [ 十二烷基三甲基溴化铵(DTAB) ,十六烷基三甲基溴化铵 ( CTAB ) ,苯扎氯铵 ] 是用 20% ( m/V ) 的水溶贮存液。这些贮存液在室温下较稳定但是对温度非常敏感。它们有时在使用前需要在 37~40°C 温浴以再溶解去垢剂。
( 4 ) IEF 用的尿素贮存液。在室温下超过 9 mol/L 的尿素是很难溶的,这是在尿素是唯一离液剂的情况下所用的浓度。这表明尿素以固体形式加入(见注释 1) 。
( 5 ) 尿素-硫脲贮存液:离液剂的终浓度是 7 mol/L 尿素和 2 mol/L 硫脲。这意味着配制 1.25 X 浓度的贮存液,比重新为每个样品称取少量的固体尿素和硫脲要简单得多。如果配制 10 ml 这种贮存液,称取 5.25 g 尿素和 1.9 g 硫脲。一些去垢剂(如 CHAPS 或 Triton X-100 ) 是与尿素完全互溶的,可以在这个阶段加入。其他去垢剂与尿素的相容性有限(如 ASB14) ,必须等到溶液最终溶解才加入。必须添加总体积 4.2 ml 的液体到尿素和硫脲,以补足 10 ml ( 见注释 2 和注释 3 ) 。这个溶液可在 -20°C 稳定贮存几个月。
( 6 ) 用于区带电泳的尿素溶液:由于尿素使用时是 4 mol/L 终浓度,因此配成 8 mol/L 的贮存液很方便。配制 10 ml,溶解 4.8 g 尿素在 6.4 ml 的水中。这个贮存液可在 4°C 稳定 2~3 天。
( 7 ) 用于区带电泳的酸性缓冲液:1 mol/L 磷酸二氢钾磷酸盐+1 μl/ml 85% 磷酸。
( 8 ) 三丁基膦(TBP ) 是一种液体(纯的为 4 mol/L ) 。在使用之前在二甲酯甲酰胺中稀释 40 倍,在样品溶液中进一步稀释 50 倍。
( 9 ) 三羧乙基磷酸酯(TCEP ) 是一种固体。用水配制 1 mol/L 贮存液,可在 -20°C 稳定贮存数月。
4. 注释
( 1 ) 尿素所占体积对于确定尿素溶液终浓度很有用。1 g 尿素在溶液中占有 0.75 ml 的体积。对于大多数去垢剂也是如此,1 g 占 1 ml 的体积,这也适用于硫脲。尿素不能加热至 37°C 以上,防止氨甲酰化。例如,1 ml 的液体中加入 900 mg 尿素,就会得到 1.675 ml 含 9 mol/L 尿素的溶液。1 g 尿素添加到 1 ml 液体中,则产生 1.75 ml 的 9.5 mol/L 尿素溶液。
( 2 ) 事实上,大部分的这些提取液含低于 50% 的水。这意味着,固体的溶解是相当困难的,特别是因为不能使用高温( 见前文注释)进行溶解。使用水浴超声仪(用于物品和玻璃器皿)对难溶问题有很大帮助。
( 3 ) 许多去垢剂不能完全与尿素互溶。不溶性的去垢剂-尿素复合物是否会形成,取决于去垢剂的结构和尿素浓度,以及温度。带有直链烷基的去垢剂链特别容易出现这个问题(如 ASB14、Brij56 )。商业直链磺基三甲铵乙内酯不能容纳 4 mol/L 以上浓度的尿素,因此不能使用。
( 4 ) 许多去垢剂强烈干扰一些常用的蛋白质测定方法,而这些方法有时也会受还原物质的干扰(见本书的相关章节),因此有必要把这方面的因素在蛋白质样品溶解过程中考虑进来。在有些情况中,蛋白样品虽然能在各种样品溶液中进行溶解但却总与蛋白检验方法相冲突。在这种情况下,我们建议使用原始蛋白样品进行蛋白浓度检测,特别是蛋白样品是悬浮液的情况。反过来,这也意味着无法评估溶解的效果。
参考文献
1. Weber, K. and Kuter, D. J. (1971) Reversible denaturation of enzymes by sodiumdodecyl sulfate. J. Biol. Chem. 246, 4504-4509.
2. Ames, G. F. L. and Nikaido, K. (1976) Two-dimensional gel electrophoresis ofmembrane proteins. Biochemistry15, 616-623.
3. Remy, R. and Ambard-Bretteville, F. (1987) Two dimensional electrophoresis inthe analysis and preparation of cell organelle polypeptides. Methods Enzymol.148, 623-632.
4. Heizmann, C. W., Arnold, E. M., and Kuenzle, C. C. (1980) Fluctuations of nonhistone chromosomal proteins in differentiating brain cortex and cerebellar neurons. J. Biol. Chem. 255, 11,504-11,511.
5. Rabilloud, T., Adessi, C., Giraudel, A., and Lunardi, J. (1987) Improvement ofthe solubilization of proteins in two-dimensional electrophoresis with immobilized pH gradients. Electrophoresis18, 307-316.
6. Castellanos-Serra, L. and Paz-Lago, D. (2002) Inhibition of unwanted proteolysisduring sample preparation: evaluation of its efficiency in challenge experiments.Electrophoresis 23, VI45-Y153?
7. Santoni, V., Molloy, M., and Rabilloud, T. (2000) Membrane proteins andproteomics: un amour impossible? Electrophoresis 21, 1054-10708 . Chevallet, M., Santoni, V., Poinas, A., et al.(1998) New zwitterionic detergentsimprove the analysis of membrane proteins by two-dimensional electrophoresis.Electrophoresis19,1901-1909.
9 . Rabilloud, T., Blisnick, T., Heller, M., et al. (1999) Analysis of membrane proteins by two-dimensional electrophoresis: comparison of the proteins extractedfrom normal or Plasmodium falciparum-infected erythrocyte ghosts. Electrophoresis 20,36 03-3610
10 . Tastet, C., Charmont, S., Chevallet, M., Luche, S., and Rabilloud, T. (2003) Structure-efficiency relationships of zwitterionic detergents as protein solubilizers intwo-dimensional electrophoresis. Proteomics3, 111-121.
11. Luche, S., Santoni, V., and Rabilloud, T. (2003) Evaluation of nonionic and zwit-terionic detergents as membrane protein solubilizers in two-dimensional electrophoresis. Proteomics3, 249-253.
1 2 . Witzmann, F., Jarnot, B., and Parker, D. (1991) Dodecyl maltoside detergentimproves resolution of hepatic membrane proteins in two-dimensional gels. Electrophoresis 1 2 , 687-688.
13. Taylor, C. M. and Pfeiffer, S. E. (2003) Enhanced resolution of glycosylphos-phatidylinositol-anchored and transmembrane proteins from the lipid-rich myelinmembrane by two-dimensional gel electrophoresis. Proteomics3, 1303-1312.
14 . Santoni, V., Kieffer, S., Desclaux, D., Masson, F., and Rabilloud, T. (2000) Membrane proteomics: use of additive main effects with multiplicative interaction modelto classify plasma membrane proteins according to their solubility and electrophoretic properties. Electrophoresis 21, 3329-3344.
15. Sanchez, J.C., Hochstrasser, D., and Rabilloud, T. (1999) In-gel sample rehydration of immobilized pH gradient. Methods Mol. Biol.11 2 , 221-225.
16. MacFarlane, D.E. (1989) Two dimensional benzyldimethyl-n-hexadecyl-ammonium chloride-sodium dodecyl sulfate preparative polyacrylamide gel electrophoresis: a high capacity high resolution technique for the purification ofproteins from complex mixtures. Anal. Biochem.176,457-463.
17. Hartinger, J., Stenius, K., Hogemann, D., and Jahn, R. (1996) 16-BAC/SDS-PAGE:a two-dimensional gel electrophoresis system suitable for the separation of integralmembrane proteins. Anal. Biochem. 240, 126-133.