定量实验做了千千万,这些细节你注意到了吗?
翊圣生物
RT-qPCR 实验包括 RNA 提取与质量评估,逆转录和 qPCR 三大步骤,每个步骤都有很多注意事项,下面给您详细介绍。
RNA 质量评估
在 RT-qPCR 实验中,RNA 提取完成后,需要对 RNA 的质量进行评估,合格后才可进行后续实验。评估方法有分光光度计,琼脂糖凝胶电泳,Agilent 2100 分析等,其中最常用的有分光光度计和琼脂糖凝胶电泳法检测。我们需要注意的是这两种方法需要搭配使用,才能完成对 RNA 浓度、纯度和完整度的检测分析,以保证 RNA 的质量。
分光光度计:
分光光度计主要用于测定 RNA 的浓度和纯度,但不能对 RNA 的完整度和基因组残留进行检测。其中,A260 / 280 和 A260 / 230 是 RNA 纯度检测的重要参数,可根据其数值的波动,检测 RNA 的纯度:
1、1.9< A260 / 280< 2.1,说明 RNA 纯度较好;A260 / 280<1.9,表示 280="" rna="">2.1,表示 RNA 可能有部分降解,可经琼脂糖凝胶电泳进一步确认。
2、2.0< A260 / 230< 2.2,说明 RNA 纯度较好;A260 / 230< 2.0,则说明 RNA 中可能有机试剂残留,如酚、乙醇或糖类等。
琼脂糖凝胶电泳:
琼脂糖凝胶电泳检测可以分析 RNA 的完整度,基因组和蛋白残留,但不能对 RNA 的浓度准确定量,也不能检测有机试剂的残留。以真核生物 RNA 模板为例:
1、 将 RNA 进行琼脂糖凝胶电泳,若胶图上只有 28sRNA、18sRNA 和 5.8sRNA 三条单一的条带,说明提取的 RNA 完整度良好。如果出现拖带的现象,表示 RNA 部分降解。
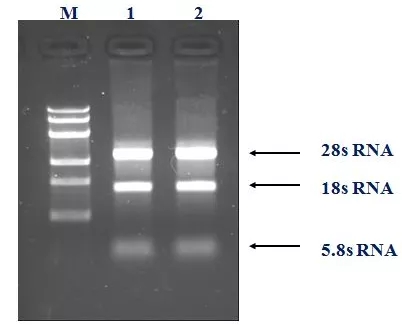
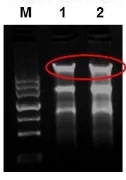
2、若胶孔和 28sRNA 条带之间出现单一明亮的条带,表示可能有基因组 DNA 残留。
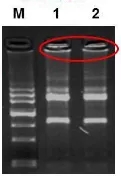
3、若胶孔内出现条带,说明可能有蛋白等大分子物质残留。
逆转录
RNA 提取完成后,需要反转成 cDNA 才能进行后续实验,所以反转步骤是必不可少的。逆转录将从逆转录酶的选择和引物的选择进行介绍:
逆转录酶的选择:
常见代表性反转录酶有 AMV RTase 和 MMLV RTase 两大类:AMV RTase 的 RNase H 活性强,合成长度短,合成量低,热稳定性好(42~55℃);MMLV RTase 的 RNase H 活性弱,合成长度长,合成量高,热稳定性差(37~42℃)。
由于 RNase H 酶具有降解 RNA 模板的功能,所以在逆转录时应该优先选择 RNase H 活性弱的 MMLV ,而且后期经过基因工程改造,MMLV 热稳定性已达到质的飞跃。以 Yeasen 的 Hifair® Ⅲ 逆转录酶(11141)为例,该酶经基因工程改造,删除了 RNase H 活性,同时反应温度可达 60℃,针对高 GC 及富含复杂二级结构的模板具有更高的反转录效率。
引物的选择:
通常 RT primer 可分为三类:oligo dT,随机引物和基因特异性引物。根据不同的实验需求选择适合的引物进行使用。
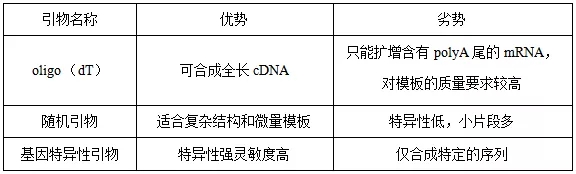
1、如果模板为真核生物来源,且后期 cDNA 用于常规 PCR 扩增,建议选择 Oligo(dT);若后续实验仅用于 qPCR,建议将 Oligo(dT)与随机引物混合后使用,可提高反转录效率。
2、如果模板为原核生物来源,反转录请选用 Random Primers 或者基因特异性引物。
荧光定量
荧光定量主要从定量方法的选择、引物设计原则、ROX 的选择、反应体系的配置和反应条件的设置等分别进行阐述:
定量方法的选择:
定量方法分为相对定量和绝对定量。相对定量可用于检测某种处理方法对基因表达的影响,检测基因在不同时间的表达差异和比较基因在不同组织中的表达差异;绝对定量可对病毒中核酸的量进行检测等。大家在做实验时,一定要根据自己的实验选择合适的定量方法。
引物设计原则:
qPCR 引物设计的好坏,直接关乎着扩增效率高低,产物特异性与否。所以正确设计出好的引物是 qPCR 成功的第一步。引物设计在满足常规引物设计的原则上还要注意以下原则:
1、 目的片段长度控制在 100 ~ 300 bp;
2、跨外显子设计,避免基因组 DNA 的影响;
3、 设计的引物需要进行扩增效率的检测,扩增效率达标(90 - 110%)才可用于定量实验;
4、 引物浓度通常在 0.1uM- 1.0uM 之间优化选择。
ROX 的选择:
在定量反应过程中,ROX 能够均一化校正仪器的光程差,移液误差或蒸发冷凝导致的体积差等,提高结果的重复性。但需要注意的是 ROX 的选择与仪器相关,如果 qPCR 仪有自动校正孔间差的功能,就不需要添加 ROX,反之则需要添加 ROX 校正。小伙伴们在买试剂时一定要根据所用的仪器型号选择正确 ROX,避免后期出错。
反应体系的配制:
反应体积优先推荐 20ul 和 50ul。体系配制时要注意以下事项:
1、 反应体系需要在超净工作台中通风配制;每次实验都要用新的 ddH2O;
2、每次实验都需要配制 NTC 来验证体系中是否存在污染,配制体系时每一对引物都需要做 NTC;
3、如果想检测 RNA 模板是否有 gDNA 残留,可将每个样本都配制 NRT 进行检测;
4、配制体系时,一个样本建议至少做 3 个技术型重复;
5、模板为 cDNA 时,建议稀释 5 - 10 倍,减少反转录体系对 qPCR 实验的抑制作用,模板量最好进行梯度摸索,使 CT 值落在 20 - 30 之间最佳;
6、确定所需的反应数量,在反应数量的基础上增加 5 - 10%,计算体积配置数量;
7、体系配制采用能预混则预混原则,混匀后离心并保证无气泡;
8、尽量选择进口且配套的耗材,如 ABI 仪器最好使用 ABI 封板膜,伯乐仪器使用配套的白色陶瓷板子。
反应条件的设定:
不同的荧光定量酶可能反应条件不一样。比如 Yeasen 的荧光定量酶就分为配体法热启动酶和抗体法热启动酶,关于这两种酶反应条件的设定需要注意以下几点:
1、设置程序时要注意配体法的预变性为 95℃,5 min;抗体法的预变性为 95℃,30s。;
2、选择两步法,可保证产物高特异,选择三步法可保证高效率扩增,小伙伴可根据自己的实验选择合适的程序;
3、上机时尽量避免使用最外面一圈的孔。
以上就是小编对 RT-qPCR 注意事项的详细总结,希望能够对大家的实验有所帮助。





