基于微流体的单细胞打印系统提高细胞系开发效率
艾贝泰
细胞系开发和单克隆性的保证是生产生物药物分子(例如单克隆抗体)过程的关键步骤。该过程开始于将编码目的蛋白的基因递送至靶细胞。在分离出能稳定表达目的蛋白的单个活细胞之后便可建立细胞系。该过程中的一个重要里程碑是记录克隆性证明,以确保细胞系的遗传可复制性。随后的步骤包括对克隆进行表征以提高生产力(效价),质量和稳定性(图1)。当前细胞系开发中的工作流程具有许多限制,包括细胞活力低,单细胞分离效率低和克隆性证据有限。有限稀释的传统分离单个细胞的方法仅依赖于统计概率,并且没有可见的单克隆证据,该技术因其单细胞沉积效率低而导致每个板的筛选候选细胞很少。
图1.上游细胞系开发中的典型工作流程
Cytena 单细胞打印系统(x.sight)是一种创新的喷墨式“打印”分选细胞的设备,用于从液体样品中温和而精确地分离单个细胞。X.sight使用一次性无菌的微流体芯片精确地分离单个细胞,同时在打印不同类型的细胞时也使交叉污染最小化了。
此文展示了使用单细胞打印机和有限稀释在单细胞沉积效率以及克隆恢复率的比较。
材料与方法
用于单细胞打印或有限稀释的细胞制备
对于单细胞打印和有限稀释,均使用CHO-K1细胞(ATCC),使用的其他细胞系,包括HEK和L929,均以类似方式制备。为了准备单细胞打印,将细胞重悬于PBS中,密度为1 x 10 6细胞/ mL。为了消除细胞团块,在将样品装入打印机芯片之前,通过40 µm过滤器过滤细胞。
通过Cytena单细胞打印系统进行单细胞分选
x.sight可从液体样品中温和而精确地分离单个活细胞,该系统使用一次性芯片,可在打印不同类型的细胞时减少了交叉污染。每个芯片可用于一次打印多个96孔或384孔微孔板。为了沉积单个细胞,x.sight通过压电驱动的致动器以可预测的顺序产生微液滴(图2A)。高分辨率相机连续拍摄芯片喷嘴处的图像,而成像算法分析喷嘴末端的图像以检测单个细胞的存在。当识别到不包含细胞或包含多个细胞的液滴时,真空系统将启动阀门,从而使这些液滴被虹吸掉。通过算法识别出单个细胞后,将触发气动系统以关闭真空阀门,从而使包裹单个细胞的液滴在打印机头移至下一个孔之前掉入下面的孔中。
单细胞来源的克隆性证据
使用高分辨率相机在喷嘴处对一次性打印芯片成像,以确保细胞出现在聚焦处。当检测到包含单个细胞的液滴时,将捕获5个图像以跟踪该单细胞下降到喷嘴末端时的状态(图2B)。在液滴形成之前捕获图像1-3,在图像4上,软件识别确认检测区域ROI中的单细胞事件,图像5显示液滴喷射之后的喷嘴。注意,基于喷嘴的图像证据与在微孔板表面获得的图像证据是互补且具有一致性的。观察到喷嘴和微孔板图像之间的高度相关性为98.9%±1.8(n = 282孔)(数据未显示)。
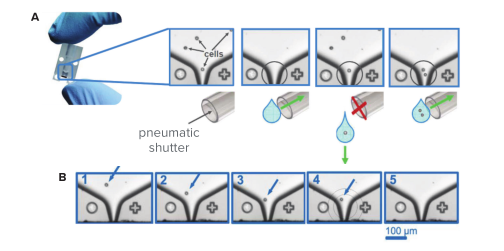
图2. Cytena单细胞打印系统技术
(A)将细胞样品装入芯片后,将芯片安装到单细胞打印系统,然后可以开始打印。在打印过程中,压电驱动的致动器会以可预测的顺序连续产生液滴。使用直接位于喷嘴下方的真空装置虹吸掉不含细胞或一个以上细胞的液滴。识别出单细胞后,真空系统关闭,使含单细胞的液滴落入孔中。(B)当检测到单个细胞时,捕获五张图像以提供喷嘴处的克隆性证据。图像1-3显示了在液滴喷射之前细胞的存在,图像4标记了包含单个细胞的区域,图像5显示了液滴喷射之后的喷嘴。
结果
Cytena单细胞打印系统和有限稀释的单细胞沉积效率对比
为了评估使用x.sight的单细胞打印效率,分析了芯片喷嘴的图像,以确保在将液滴喷射到孔中之前观察到真正的单细胞事件。根据仪器喷嘴成像的分析结果,使用x.sight获得的单细胞打印总效率为88.5%±5.5(n = 9个微孔板)。两/多细胞孔和无细胞孔的发生频率要低得多(分别为6.7%和4.8%)。每个96孔微孔板的平均打印时间为8.1±2.8分钟。一张图片说明显示,x.sight打印至96孔微孔板的典型结果为85孔包含1个细胞,6孔包含> 1个细胞和5孔不包含细胞(图3A)。相比之下,理论接种密度为0.5个细胞/孔的有限稀释液可实现30%的单细胞孔(28个),10%的多细胞孔(10个)和60%的空孔(58个)(图3B)。图3c显示了单细胞打印和有限稀释的空孔、单细胞孔和多细胞孔效率的直接比较。与有限稀释相比,x.sight的单细胞沉积效率提高了约3倍,从而增加了用于下游分析的潜在克隆数。
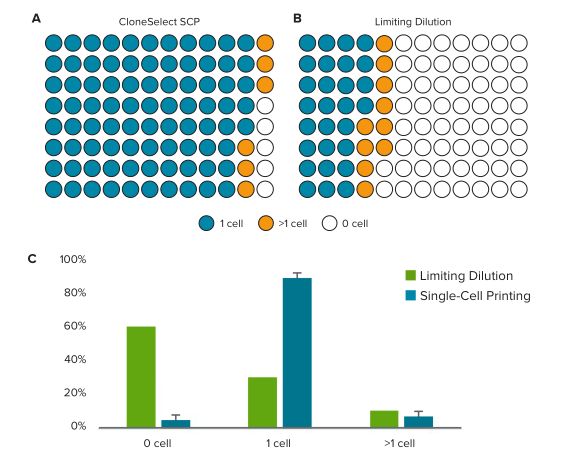
图3. x.sight与有限稀释的单细胞沉积效率对比
克隆恢复率
随后测试了单细胞打印产生的克隆的生存能力,并将它们与有限稀释产生的克隆进行了比较。为了量化生存力,将来自有限稀释或单细胞打印的微孔板定期在成像设备上成像10天,直到形成明显的细胞团。图4A显示了x.sight的第10天代表性板块中,包含大量单克隆孔(总共70孔)。图4B中显示了有限稀释的第10天板,其中包含27个单克隆孔。
将来自x.sight和有限稀释的每孔的克隆团进行计数,并分类为以下三类之一:空孔,单克隆孔和多克隆孔。观察到有63.0%±6.5的孔包含单细胞打印产生的单克隆孔(其中1.5%±1.4包含多个克隆,而35.5%±7.3则不含克隆)。同时,观察到有限稀释的结果是26.2%±2.3的孔包含单个克隆(其中66.4%±3.9不含克隆,而7.4%±1.9包含多个克隆)。图4C绘制了来自x.sight和有限稀释的每块板的原始单细胞克隆。为了直接测量单细胞活力,在第0天捕获了荧光标记的细胞,使其生长10天。对于给定的板,通过将单克隆孔的数目(单细胞孔长起来的)除以单细胞孔的数目来获得生存力百分比。x.sight的平均生存力为84%,而极限稀释度则为81%。同样,比较了来自x.sight的单细胞来源克隆对不同细胞类型的生存力(图4E)。通常,使用CHO,HEK和其他常见细胞系时,观察到的典型生存力大于75%。重要的是要注意,细胞活力会根据细胞类型,样品制备,设定参数,细胞培养基和其他外部因素而变化。
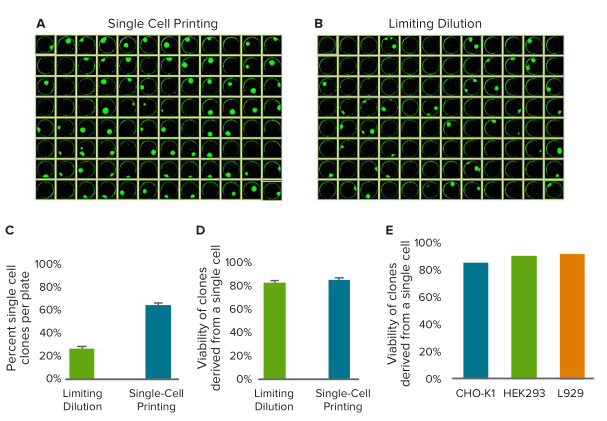
图4.单细胞打印机和有限稀释的存活率对比
(A)显示了来自单细胞打印的第10天细胞团(绿色)。70个孔包含单个克隆团,1个孔包含2个克隆团,25个孔不包含克隆团。(B)有限稀释平行产生的第10天细胞克隆团。27个孔包含单个克隆团,7个孔包含多个克隆团,62个孔不包含克隆团。(C)x.sight和有限稀释来源的每块板单细胞克隆率的比较。(D)比较了有限稀释与x.sight来源的单细胞克隆的存活率。x.sight的平均生存力为84%,而有限稀释则为81%。(E)比较了从不同类型细胞获得的单细胞来源孔的生存力。
结论
本文展示了使用Cytena单细胞打印系统(x.sight)的工作流程,该工作流程可提高单细胞分离的效率并记录单克隆性。x.sight技术为单克隆,高效,快速的单细胞接种以及出色的细胞活力以及最小的交叉污染风险提供了基于图像的证据。单细胞沉积效率高(> 85%),可以更全面地使用微孔板的孔来有效分离单个细胞。在此工作流程中,克隆回收率提高了3倍,这意味着可以在下游分析更多克隆,从而在提高生产率的同时节省了人工时间和试剂成本。
本文只是尝试了一种细胞密度来进行单细胞的分选,根据国内外客户的反馈信息,调整细胞的密度进行铺板,单细胞率和克隆生长率能分别提高到95%和91%以上(由于信息保密性,数据尚未显示)。







