体内碱性彗星试验原理及注意事项
体内碱性彗星试验在化合物遗传毒性评价中的应用日益广泛。ICH S2(R1) 已将肝脏彗星试验列为第 2 个组织/终点的体内试验;体内哺乳动物碱性彗星试验的指导原则(TG489)也已颁布。体内碱性彗星实验能够检测 DNA 链断裂、碱性不稳定位点、不完整切除修复引起的 DNA 链的断裂,能够制成合适细胞悬液的组织 DNA 损伤。与其他试验相比其检测的是单细胞水平的 DNA 损伤,因此该试验敏感性较高,操作简单,经济省时。
实验原理
彗星实验(comet assay)也称单细胞凝胶电泳试验(single cell gel electrophoresis.SCGE), 是一种有效评估 DNA 损伤的方法。其原理是器官或组织经处理(如辐射、重金属等)后,细胞中的 DNA 发生单链或双链断裂,经细胞及其核膜裂解后,DNA 解旋,在电场作用下,DNA 断片迁移出细胞核,形成彗星状的电泳图谱。正常细胞的大分子 DNA 在电场作用下迁移距离较短,DNA 仍保留在细胞核的范围,形成圆形或轻微拖尾的图谱。根据电泳缓冲液的 pH 值不同,可分为中性彗星实验(pH = 8.4)和碱性彗星实验(pH>13)。中性彗星实验主要用于检测 DNA 双链的断裂损伤,碱性彗星实验具有更高的灵敏性,可用于检测更少量的单链和双链断裂损伤。
需要注意的是,试验过程中的个方面,包括样品准备、电泳条件、视觉分析参数 (如染色强度、显微镜光强度以及使用显微镜滤镜和相机动态和环境条件 (如背景照明) 已经被研究,可能影响 DNA 迁移。
 |  |
图一:DNA 损伤彗星细胞
 |  |
图二:正常细胞
碱性彗星实验指导原则
TG489 In Vivo Mammalian Alkaline Comet Assay,2016,OECD Guideline for the Testing of Chemicals
试验能力验证
每个实验室都应证明能够为所使用的目标组织获得足够质量的单细胞或细胞悬浮液,从而在彗星试验(comet assay)中建立实验能力。汇智泰康拥有多年毒理学服务与产品研发经验,针对不同遗传毒性试验开发针对试剂盒,包括彗星试验试剂盒。首先通过 % 尾 DNA 的评价,对照处理组动物 % 尾 DNA 在低范围内。目前的数据表明, 尾部 DNA 百分比 (基于平均中位数) 在大鼠肝脏应该最好不要超过 6%, 这将是符合 JaCVAM 验证试验的值和其他出版和私有数据。目前还没有足够的数据对其他组织的最佳或可接受范围提出建议。这并不排除合理使用其他组织。测试报告应根据已发表的文献或专有数据,对彗星试验在这些组织中的性能进行适当的审查。首先,在对照组中,需要一个较低的 % 尾 DNA 范围,以提供足够的动态范围来检测阳性的影响。其次,每个实验室都应能够按照表 1 所建议的不同方式,对直接诱变剂和促进剂的反应。
表一:阳性对照物质及其部分靶组织
阳性对照物 | 靶组织 |
Ethyl methanesulfonate | 任何组织 |
Methyl methanesulfonate | 肝脏、胃、十二指肠或空肠,肺和支气管肺泡灌洗 (BAL) 细胞,肾脏,膀胱,肺,睾丸和骨骼骨髓/ |
Ethyl nitrosourea | 肝胃,十二指肠或空肠 |
N-Methyl-N'-nitro-N-nitrosoguanidine | 胃、十二指肠或空肠 |
1,2-Dimethylhydrazine 2 HCl | 肝脏和肠 |
N-methyl-N-nitrosourea | 肝脏,骨髓,血液,肾脏,胃、空肠和大脑。 |
应收集阴性对照数据,以证明阴性数据反应的再现性,并确保对检测的技术方面进行适当控制,或建议需要重新建立历史控制范围。
历史对照
在实验室能力验证过程中,实验室应建立历史数据库,建立相关组织和物种的阳性和阴性对照范围和分布。不同的组织和不同的物种,以及不同的给药溶媒和给药途径,可能会产生不同的 % 尾 DNA 阴性对照值。因此,建立每个组织和物种的阴性对照范围是很重要的。实验室应采用质量控制方法,以确定其数据的变化程度,并表明该方法在其实验室中得到了「控制」。可能还需要优化选择适当的阳性对照物质、剂量范围和实验条件 (例如电泳条件),以便发现微弱的影响。
对实验方案的任何更改都应根据其与实验室现有历史控制数据库的一致性加以考虑。任何重大的不一致都应导致建立新的历史控制数据库。
方法描述
动物选择:通常使用健康成年啮齿动物 (6-10 周龄,但年龄稍大的动物也可接受)。然而,如果合乎伦理和科学,其他物种也可以被利用。
动物准备:动物随机分为对照组和实验组。在开始实验前,这些动物适应实验室条件至少 5 天,给予标识识别。试验开始时, 动物的重量差异应该不超过±20%。
样品制备:在给动物给药前,固体测试化学品应溶解或悬浮在适当的溶媒中,或混合在饮食或饮用水中。液体试验化学品可直接加药或在加药前稀释。对于吸入暴露,根据其物理化学性质,试验化学品可以作为气体、蒸汽或固体/液体气溶胶使用。
溶媒:在使用的剂量范围内,溶媒不应产生毒性作用,也不应与试验物质发生化学反应。如果使用的不是常用溶媒应提供参考数据,说明它们在测试动物、管理路线和终点方面的兼容性。建议在可能的情况下,应首先考虑使用水性溶剂/溶媒。值得注意的是,一些溶剂可诱导炎症反应,增加接触部位 DNA 链断裂的背景水平,尤其是与多药给药时。
阴性对照:阴性对照动物,单独用溶媒处理,其他处理方法与治疗组相同,每一次采样时间和组织的每次检测均纳入一组阴性对照动物。阴性对照动物的尾部 DNA 应在每个组织预先设定的实验室背景范围和该物种的取样时间内。
动物数量和性别:目标是每组提供至少 5 只可分析的单性别动物,或如果使用两种动物,则每组至少提供 5 只可分析的单性别动物。如果人类接触到的化学物质可能具有性别特异性,例如某些药物,则应在适当的性别下进行检测。三个剂量组和同时进行的阴性和阳性对照 (每一组由 5 只单性别动物组成),将需要 25 至 35 只动物。
试验计划:动物应接受为期 2 天或以上的每日给药 (即每隔约 24 小时进行两次或两次以上),并在最后一次治疗后的 2-6 小时采集一次样本。延长剂量方案 (如 28 天每日给药) 的样本是可以接受的。测试化学品也可以分次使用,即,两组给药在同一天间隔不超过 2-3 小时,便于给药量大。在这种情况下,取样时间应根据最后一次给药的时间来安排。
剂量水平:对无毒试验化学品,给药 14 天以上的,最大 (限) 剂量为 1000 mg /kg 体重/天。给药时间少于 14 天,最高剂量为 2000 毫克/公斤体重/天。对于特定法规所涵盖的特定类型的测试化学品 (如人类药物),这些限制可能有所不同。在长期给药后表现出毒物动力学性质饱和或诱导排毒过程而可能导致接触减少的物质,可能是剂量设定标准的例外,应逐个进行评估。
急性和亚急性的彗星试验, 除了最大剂量 (MTD, 最大可行的剂量, 最大接触或限制剂量) 递减序列至少两个额外的适当间隔的剂量水平 (最好相隔不到√10) 应该选择为每个采样时间证明剂量相关的反应。但是,所使用的剂量水平也最好包括从最大限度到产生很少或没有毒性的剂量范围。当检测到所有剂量水平的靶组织毒性时,建议进一步进行无毒剂量的研究。为了更全面地调查剂量-反应曲线的形状,可能需要进行研究。
在设计试验时,应考虑人体接触的预期途径。因此,暴露途径,如饮食、饮水、局部、皮下、静脉、口服 (灌胃)、吸入、气管内或植入术可能是合理的。无论如何,应选择适当的路径以确保目标组织得到充分暴露。腹腔注射通常不推荐使用,因为它不是典型的人体接触的相关途径,只能在有特定理由的情况下使用 (例如,一些阳性对照物质,用于调查目的,或用于腹腔注射途径所使用的某些药物)。一次灌胃或注射液体的最大容量取决于试验动物的大小。体积不应超过 1 毫升/100 克体重,但可使用 2 毫升/100 克体重的水溶液除外。如果动物福利立法允许,使用比这更多的量是合理的。在可能的情况下,应通过调整剂量配方的浓度来达到不同的剂量水平,以确保在所有剂量水平上的体积相对于体重是恒定的。
采样时间:采样时间是一个关键变量,因为它是由测试化学物质在目标组织中达到最大浓度所需的时间和 DNA 链断裂的诱导时间决定的,但在这些断裂被移除、修复或导致细胞死亡之前。彗星实验(comet assay)检测到的一些导致 DNA 链断裂的损伤持续时间可能很短,至少对于一些体外测试的物质来说是这样。因此,如果怀疑这种短暂的 DNA 损伤,应采取措施减轻其损失,确保组织得到足够早的采样,可能早于下面给出的默认时间。最佳采样时间可能是特定于物质或路径的采样时间,例如,静脉给药或吸入给药导致组织快速暴露。因此,在可能的情况下,应根据动力学数据 (如血浆或组织浓度达到峰值的时间 (Tmax) 或多次给药的稳态时间 (Cmax) 确定采样时间。在缺乏动能的测量数据合适的妥协基因毒性是样品 2-6 h 后给药两次或两次以上, 或 2-6 和第 16 - 26 h 后。关于目标器官中毒性作用外观的信息也可用于选择适当的取样时间。
组织收集:因为它可以研究诱导的 DNA 链断裂 (彗星) 在任何组织中, 组织选择应清晰、基于收集的原因进行研究与任何现有的基因毒性、致癌性或其他测试物质的毒性数据在调查之中。应考虑的重要因素应包括给药途径、预测的组织分布和吸收、代谢的作用以及试验物质可能的作用机制。肝脏是研究最频繁、数据最丰富的组织。因此,在缺乏任何背景信息的情况下,如果没有确定感兴趣的特定组织,那么对肝脏进行取样是合理的,因为肝脏是异种生物代谢的主要场所,而且常常高度暴露于母体物质和代谢物中。在某些情况下,直接接触部位的检查 (例如,口服药物,胃腺或十二指肠/空肠,或吸入药物,肺) 可能是最相关的。应根据进行测试的具体原因选择其他或替代组织,但如果实验室已证明对这些组织的熟练程度和同时处理多个组织的能力,对同一动物的多个组织进行检查可能是有用的。
样本制备:在最后一次用测试化学品后的适当时间,对动物实施安乐死。收集选定的组织, 而同时采集同一组织的一部分, 放置在甲醛溶液或适当的固定剂可能组织病理学分析。彗星实验的组织被放置在切碎缓冲液中,用冷切碎缓冲液充分冲洗以去除残留的血液,并储存在冰冷的切碎缓冲液中,直到处理完毕。原位灌注也可进行,如肝、肾灌注。
玻片准备:单细胞悬液制备后,应尽快 (最好在 1 小时内) 制备载玻片,但动物死亡与载玻片制备之间的温度和时间应严格控制,并在实验室条件下进行验证。向低熔点琼脂糖 (通常 0.5-1.0%) 中加入细胞悬浮液的体积,使玻片的低熔点琼脂糖百分比不应降低到 0.45% 以下。最佳的细胞密度将由用来给彗星评分的图像分析系统决定。
细胞裂解:裂解条件也是一个关键变量,可能会干扰特定类型的 DNA 修饰 (某些 DNA 烷基化和碱基内收) 导致的链断裂。因此,我们建议在实验中对所有玻片的裂解条件尽可能保持恒定。准备好后,应在约 2-8 摄氏度的弱光条件下 (如黄光 (或防光),将载玻片浸入冷冻溶解液中至少 1 小时 (或过夜),以避免暴露在可能含有紫外线成分的白光下。在此潜伏期之后,在碱液展开步骤之前,应冲洗载玻片以除去残留的洗涤剂和盐。这可以用纯净水、中和缓冲液或磷酸盐缓冲液来完成。也可以使用电泳缓冲液。这将维持电泳室的碱性条件。
解旋和电泳:将载玻片随机放置在含有足够电泳溶液的潜电泳装置的平台上,使载玻片表面完全覆盖 (每次覆盖的深度也应一致)。在其他类型的彗星试验电泳装置,即主动冷却,循环和高容量电源,较高的解决方案覆盖将导致更高的电流,而电压保持不变。在电泳槽内放置载玻片应采用平衡设计,以减轻槽内任何趋势或边缘效应的影响,并尽量减少批与批之间的差异,即,在每次电泳中,研究中每个动物的载玻片数量应相同,并应包括来自不同剂量组 (阴性和阳性对照) 的样本。应该留给 DNA 解旋至少 20 分钟, 然后进行电泳受控条件下, 测定的灵敏度和动态范围最大化 (即导致尾部 DNA 百分比的可接受水平的正面和负面的控制灵敏度最大化)。DNA 迁移水平与电泳时间线性相关,也与电位 (V/cm) 线性相关。根据 JaCVAM 试验,这可能是 0.7 V/cm,持续至少 20 分钟。电泳时间被认为是一个关键的变量,需要设置电泳时间来优化动态范围。较长的电泳时间 (如 30 或 40 分钟,以提高灵敏度) 通常会导致较强的阳性反应已知的诱变。然而,较长的电泳时间也可能导致过度迁移的控制样本。在每个实验中,电压应保持恒定,其他参数的变异性应在一个较窄的指定范围内。调节缓冲深度,达到要求,并在整个实验过程中保持。应记录电泳开始和结束时的电流。因此,最佳条件应在实验室中与所研究的每个组织有关的熟练程度的初步演示期间确定。通过展开和电泳的电泳溶液的温度应保持在低温下,通常为 2-10oC(10)。
电泳完成后,将载玻片在中和缓冲液中浸泡/冲洗至少 5 分钟。凝胶可以被染色并标记为「新鲜」(例如在 1-2 天内),也可以被脱水以便以后的标记 (例如在染色后 1-2 周内)。但是,这些条件应该在熟练程度的展示过程中得到验证,并且应该为每个条件分别获得和保留历史数据。如果是后者,则应将玻片浸入无水乙醇中脱水至少 5 分钟,风干,然后储存在室温或冰箱容器中。
测量方法:彗星应该使用自动化或半自动化的图像分析系统进行定量评分。用合适的荧光染色剂对载玻片进行染色,并在配备有超荧光和适当检测器的显微镜或数码相机上进行适当放大 (如 200x) 的测量。
根据彗星图像图谱的描述,细胞可以分为三种类型,即可分析、不可分析和「刺猬。只有可分析的细胞 (明确定义的头部和尾部,不干扰相邻的细胞) 应该为 % 的尾部 DNA,以避免人为干扰。刺猬的频率应该根据每个样本至少 150 个细胞的视觉评分 (因为缺少一个清晰定义的头部意味着它们不容易被图像分析检测到) 来确定,并单独记录下来。
所有用于分析的玻片,包括阳性和阴性对照的玻片,都应独立编码并进行「盲法」评分,以便评分者不知道情况。对于每个样本 (每个动物的每个组织),至少应该分析 150 个细胞 (刺猬除外)。分析 150 细胞/动物至少 5 动物每剂,提供足够的统计能力。
彗星 DNA 链断裂可以通过尾 DNA %、尾长和尾力矩等独立端点来测量。如果使用适当的图像软件分析仪系统,就可以进行这三种测量。然而,推荐将 % 尾 DNA(也称为 % 尾强度) 用于结果的评估和解释,并由以细胞总强度百分比表示的尾 DNA 片段强度决定。
数据处理和结果判断
在实验条件下,阳性对照组的尾 DNA% 的与阴性对照相比具有统计学意义上的增加(p<0.05)时,判定试验系统有效。
在试验系统判定有效的前提下,同时满足以下三个条件,则判定受试样品为阳性结果:
(1)尾 DNA% 的在某个单独剂量组显著升高;
(2)尾 DNA% 随试验样品浓度升高有显著增加趋势;
(3)受试物组的尾 DNA% 全部超过阴性背景数据范围。
在判定阳性结果时,如仅符合上述标准中的一个或两个,除统计学意义外,还应考虑其生物学意义。
如全部不符合上述 3 个,则判定为阴性结果。
试验报告
试验报告应包括以下内容:
(1)受试物来源如批号。
(2)测试化学品的稳定性、使用限制日期或已知的重新分析日期。
(3)化学识别,如 IUPAC 或 CAS 名称、CAS 编号、SMILES 或 InChI 代码、结构公式、纯度、杂质的化学识别 (视情况和实际可行) 等。
(4)多组分物质,UVBCs 和混合物, 尽可能用化学特性 (见上文)、定量发生和表征化学成分的相关理化性质。
(5)溶剂选择的理由,已知测试化学品在溶剂/溶媒中的溶解性和稳定性;剂量制剂的制备;对配方 (例如稳定性、均匀性、名义浓度) 的分析测定。
(6)实验动物:所使用的品种,以及作出选择的科学和伦理理由;动物的数目、年龄和性别;来源、居住条件、饮食、营养等;试验开始和结束时动物的体重,包括每组动物体重的范围、平均值和标准差。
(7)测试条件:阳性和阴性控制数据;测距研究的结果 (如进行);剂量水平选择的理由;测试化学制剂的详细资料;测试化学品的管理详情;行政路线的基本原理; 注射部位 (用于皮下或静脉注射研究);样品制备方法,如有,组织病理学分析,特别是对彗星反应阳性的物质。
(8 组织选择的基本原理:如果检测结果为阴性,则验证该测试化学品是否达到目标组织或一般循环的方法;
根据膳食/饮用水试验化学浓度 (ppm) 和消耗量 (如适用) 计算的实际剂量 (mg/kg 体重/日);
饮食及水质详情;详细说明实验方案和取样计划以及选择的理由 (如有毒物动力学数据);-止痛、镇痛方法;-安乐死的方法;分离和保存组织的程序; 制备单细胞悬液的方法; 所有试剂的来源和批号 (如有可能);评价细胞毒性的方法;电泳条件;使用染色技术;评价和测量彗星的方法。
(9)结果: 对每只动物在试验前和整个试验期间进行一般临床观察 (如有);进行细胞毒性试验的证据;超过一周的研究: 研究期间的个体体重,包括各组体重范围、平均值和标准差; 剂量-反应关系明显;对于每个组织/动物,% 的尾部 DNA(或其他测量方法,如果选择) 和每张玻片的中位数,每只动物的平均值和每组的平均值;同步和历史阴性对照数据,包括评估的每个组织的范围、平均值/中位数和标准差;并发和历史正控制数据;对于肝脏以外的组织,使用阳性对照的剂量-反应曲线。
(10)应用的统计分析和方法。
(11)讨论结果和结论。
彗星试验试剂盒
北京汇智泰康针对碱性彗星试验开发彗星试验试剂盒,本试剂盒提供了彗星试验(单细胞凝胶电泳试验)需要的主要试剂盒耗材,省去了细胞裂解液、细胞悬液、碱性电泳液、电溶胶配制等时间,可以直接使用,大大缩短了实验周期;试剂盒各成分均经过严格的质量检测和多次试验验证,符合碱性彗星试验要求,实验结果准确、可靠、重现性高。
碱性彗星试剂盒应用广泛,可进行食品与饮用水、化学品、洗涤剂、消毒剂、食品添加剂、药物残留、化妆品、容器与包装材料等多个方面的遗传毒性检测评价。
【产品说明】
本试剂盒提供了单细胞凝胶电泳试验(single cell gel electrophoresis,SCGE)需要的试剂和耗材。
包装盒 | 产品组成 | 规格 | 数量 | 保存条件 |
碱性彗星实验盒 | 细胞裂解液 | 500 mL | 1 | 室温 |
电泳胶 A | 10 mL | 1 | 室温 | |
电泳胶 B | 15 mL | 1 | 4℃ | |
玻片 | 2 孔 | 25 | 室温 | |
EDTA | 12.5 mL | 1 | 室温 | |
核酸染料 | 10 ul | 1 | 4℃ | |
DMSO | 50 mL | 1 | 室温 |
1. 细胞裂解液避免了多成分配制的繁琐工艺,保证了每次实验细胞裂解的稳定性。
2. 电泳胶经过采用先进工艺规模化制备,出厂前经过严格的质量检测,实验时直接溶解即可使用。
3. 针对实验设计的两孔式玻片增加了溶胶的粘附性,使细胞完整,便于拍照分析。
【试剂盒应用范围】
本试剂盒应用范围非常广,可进行食品与饮用水、化学品、洗涤剂、消毒剂、食品添加剂、药物残留、化妆品、容器与包装 材料等遗传毒理学检测。
【传统试验操作不足】
1. 溶液配制繁琐,每次配制裂解效果不同。
2. 不同胶浓度会影响 DNA 尾百分数,过低浓度的胶稳定性差,过高浓度的胶会抑制彗星尾的产生,且反复溶胶会导致储备液蒸发,影响试验结果。
3. 传统玻片对溶胶的粘附性较低,且溶胶易流出玻片,损失较大。
【试剂盒优势】
便捷——本试剂盒省去了裂解液配制时间,可以直接使用,大大缩短了实验周期。
准确——本试剂盒各成分均经过严格的质量检测,实验结果准确、可靠、重现性高。
稳定——本试剂盒稳定性强、易于运输和保存。
【产品使用说明】
仪器和设备
干热烤箱、低温冰箱 (-80℃) 或液氮生物容器、普通冰箱、天平 (精密度 0.1 g 和 0.0001 g)、双稳定电泳仪、电泳槽、倒置荧光显微镜和低速冷冻离心机等。
试剂配制
实验开始前,请根据说明书要求自行准备实验所需试剂及耗材。
PBS 缓冲液配制(1 L) | ||
试剂 A | 12.07 g | 溶解后,先调 pH 至 7.4,再定容至 1L。 |
超纯水 | 定容至 1L | |
细胞悬液制备缓冲液配制(1 L) | ||
PBS 缓冲液 | 900 mL | 混合均匀后,4℃ 保存备用。 |
试剂 B | 100 mL | |
细胞裂解液配制(500 mL) | ||
试剂 C | 445 mL | 使用时,先加入 5 mL 试剂 D 混匀,再加入 50 mL DMSO 混匀。 |
试剂 D | 5 mL | |
DMSO | 50 mL | |
电泳胶准备 | ||
电泳胶 | 90~100℃ 水浴溶胶 5 min | 37 ℃ 保存 20 min 后待用。 |
碱性电泳液配制(1 L) | ||
试剂 B | 5 mL | 使用时,先将试剂 B、E 完全溶解后,再定容至 1 L, 4℃ 保存备用。 |
试剂 E | 8 g | |
超纯水 | 定容至 1L |
注:可根据实验实际需求改变试剂的配制量。
单细胞悬液制备
(1)悬浮细胞:细胞悬浮液经离心分离获得。将细胞以 1×105 个/ml 的速度悬浮于 1X PBS(不含 Ca+和 Mg+) 中。
(2)贴壁细胞:轻轻从皿底分离细胞。将细胞和培养基转移到离心管中,进行细胞计数。用 1X PBS (不含 Ca+和 Mg+) 冰洗一次。将细胞以 1×105 个/ml 的速度悬浮于 1X PBS(不含 Ca+和 Mg+) 中。
(3)组织制备:称取组织约 0.05 g,加入制备缓冲液(含 20 mmol/L EDTA-Na2 的 PBS)立即剪碎,冲洗。迅速研磨组织,过滤,整个过程在冰上操作。离心重悬,计数单细胞悬液密度约在为 1×105~4×105 个/mL。
制片、裂解、解旋及电泳
(1)取 120μL 浓度为电泳胶 A 趁热铺于磨砂载玻片上,形成底胶,用盖玻片推匀,不能有气泡,4℃ 凝固 20 min。
(2)水平取下盖片,取 80 μL 电泳胶 B 与 20μl 细胞悬液混匀,立即铺片,加上盖玻片,4℃ 凝固 5 min,形成第二层胶。再取 80μL 电泳胶 B 铺在第二层胶上,4℃ 凝固 5 min,形成第三层胶。保证细胞均匀分布于每孔,每个样本平行 2 孔。
(3)细胞裂解:将玻片置于平皿中,加入预冷的裂解液(裂解液:DMSO = 10:1),4℃ 过夜裂解,裂解液平面刚好没过玻片表面。裂解后,倒掉裂解液,用超纯水清洗 3 次,5 min/次。
(4)解旋:加入预冷的解旋液(pH>13)没过玻片,4℃ 避光解旋 1 h。
(5)电泳:预先将电泳槽置于冰盒内,冷却备用。将解璇后的细胞玻片置于电泳槽,倒入电泳液,调整电压 22-24V,电流约为 300Ma,电泳 20 min。电泳结束后,取出玻片,轻轻擦拭,去除多余液体。超纯水清洗 2 遍,无水乙醇脱水 1 遍,5 min/次。37℃ 烘干。
染色、拍照及分析
染色时将稀释过的 Gene Red : Tris-Hcl 1:6000,加到玻片每孔表面,每孔 100μL,避光染色 30 分钟。超纯水清洗 3 遍,去除多余液体,37℃ 烘干或室温避光晾干。
拍照前关闭实验室光源,使用 CASP1.2.3beta2 彗星图像分析软件进行分析,每只动物都要分析 150 个可分析的尾 DNA 含量百分率的中位数。分析过程中如遇刺猬细胞进行标记。
【注意事项】
1. 本试剂盒仅供科研使用,不可用于诊断程序。
2. 实验开始前,请自行准备 DMSO、超纯水、手术器械、筛网、无水乙醇、染色液、水平电泳槽等。
3. 使用组织进行彗星试验时,需注意细胞制备需全程在冰上进行,且保证在 1 h 内完成铺片。
4. 电泳胶使用时需提前水浴融化,禁用微波。
5. 因各实验室条件不同,各种激发光源所需染色液各异,本试剂盒未提供染色液。推荐的染色液包括但不局限于 Gene Red、SYBR Green、SYBR Gold 等。
6. 清洗玻片时注意不要直接将液体倾倒至胶面,防止脱胶。
 | 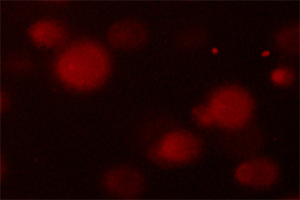 |
图 1 阳性对照 图 2 阴性对照
注:附图仅供参考,以实际为准。
常见问题及原因分析
1. 大鼠麻醉处死后,取肝脏样品制备要注意肝的保存温度及保存时间、冷冻组织以及一些其他诸如取样所用缓冲溶液、所取肝脏组织大小等因素。取好的肝脏在制成单细胞悬液前最多在冰上保存 1 h。一半彗星实验所取的肝脏大小约为 0.05 cm³。
2. 如需将组织冷冻,应将组织取出后迅速并深度冷冻,直至制备单细胞悬液时取出。
3. 解旋时间会影响 DNA 尾百分数,DNA 尾百分数随着解旋时间的延长而增长。
4. 电泳时间会影响 DNA 尾百分数,细胞 DNA 迁移随着电泳时间的增长二增长。可以通过改变电压提高试验的灵敏度,推荐电压为 0.7V/cm。
5. 如有其他技术问题,可联系汇智泰康。
图片来源:汇智泰康