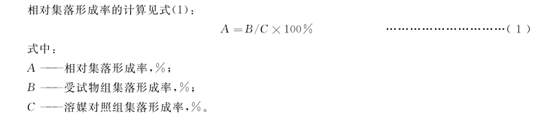体外微核试验原理及注意事项
&北京汇智泰康医药技术有限公司
微核试验是遗传毒性研究标准组合试验之一,在食品,化学品,药品,农药,饮用水等多类产品的遗传毒性评价方面得到广泛应用。与体内实验相比,体外微核试验更加简单快速,避免动物个体差异影响,灵敏度高。体外微核试验主要包括体外哺乳类细胞微核试验,人外周血淋巴细胞微核试验,肝原代细胞微核试验等类别。
体外哺乳类细胞微核试验是一种用于检测哺乳类细胞在受试物处理后是否产生微核的遗传毒性检测方法。该试验适用于检测有丝分裂细胞暴露于受试物期间或之后致染色体断裂和诱发非整倍体的能力。如果 3 h~6 h 短期处理的试验结果为阴性或不确定时,需要进行无代谢活化系统的长期处理试验,相当于用受试物处理细胞 1.5 个~2.0 个正常细胞周期。
参考导则:
GB 15193.28 - 2020 食品安全国家标准 体外哺乳类细胞微核试验
一、仪器、试剂
1.1 仪器
细胞培养箱、倒置显微镜、正置显微镜、超净台、离心机。
1.2 代谢活化系统
1.2.1 S9 辅助因子的配制
1.2.1.1 镁钾溶液
氯化镁 1.9 g 和氯化钾 6.15 g 加蒸馏水溶解至 100 ml。
1.2.1.2 0.2 mol/L 磷酸盐缓冲液 (pH 7.4)
磷酸氢二钠 (Na2 HPO4,28.4 g/L)440 mL, 磷酸二氢钠 (NaH2PO4·H2O,27.6 g/L)60 mL,调 pH 至 7.4,0.103 MPa 20 min 灭菌或滤菌。
1.2.1.3 辅酶-Ⅱ(氧化型) 溶液
无菌条件下称取辅酶-Ⅱ,用无菌蒸馏水溶解配制成 0.025mol/L 溶液,现用现配。
1.2.1.4 葡萄糖- 6 -磷酸钠盐溶液
称取葡萄糖- 6 磷酸钠盐, 用蒸馏水溶解配制成 0.05 mol/L 溶液,过滤灭菌。现用现配。
1.2.2 大鼠肝 S9 组分的诱导和配制
选健康雄性成年 SD 或 Wistar 大鼠,体重 150 g~200 g,约 5 周龄~6 周龄。将多氯-联-苯 (Aroclor 1254) 溶于玉米油中,浓度为 200 g/L,按 500 mg/kg 体重无菌操作一次腹腔注射,5 d 后处死动物,处死前禁食 12 h。
也可采用苯巴比-妥-钠和β-萘黄酮联合诱导的方法进行制备,经口灌胃给予大鼠苯巴比-妥-钠和β-萘黄酮,剂量均为 80 mg/kg 体重,连续 3d,禁食 16 h 后断头处死动物。其他操作同多氯联苯诱导。
S9 组分制成后,经无菌检查,测定蛋白含量 (Lowry 法),每毫升蛋白含量不超过 40 mg 为宜,并经间接致突变剂鉴定其生物活性合格后贮存于- 80°C 低温或冰冻干燥,保存期不超过 1 年。
1.2.3 S9 混合液的制备
S9 混合液浓度一般为 1%~10%,实际使用浓度可由各实验室决定,但需对其活性进行鉴定,必须能明显活化阳性对照物,且对细胞无明显毒性。
一般由 S9 组分和辅助因子按 1:9 组成 10% 的 S9 混合液,无菌现用现配。10%S9 混合液 10 mL 配制方法如下: 取上述磷酸盐缓冲液 6.0 mL、镁钾溶液 0.4 mL、葡萄糖- 6 -磷酸钠盐溶液 1.0 mL、辅酶 II 溶液 1.6 mL、肝 S9 组分 1.0 mL,混匀,置冰浴中待用。
1.3 肌动蛋白聚合抑制剂细胞松弛素 B(CytochalasinB,cytoB) 溶液
用二甲基亚砜 ( DMSO) 配制适当浓度的储备液,避光冷藏保存。cytoB 的终浓度通常为 3 μg/ mL ~6 μg/mL,实验室应根据各种细胞系选择 cytoB 的适当终浓度,以达到理想的双核细胞出现频率。
1.4 0.075 mol/L 氯化钾溶液
5.59 g 氯化钾加蒸馏水至 1000 ml。
1.5 固定液
甲醇: 冰醋酸为 3:1,临用前配制。
1.6 姬姆萨 (Giemsa) 染液
取姬姆萨染料 3.8 g ,置乳钵中,加少量甲醇研磨。逐渐加甲醇至 375 mL,待完全溶解后,再加 125 mL 甘油,放入 37° C 温箱中保温 48 h。保温期间振摇数次,使充分溶解。取出过滤,2 周后使用,作为姬姆萨染液原液。使用时, 取 1 份姬姆萨染液原液,与 9 份 1 / 15 mol/L 磷酸盐缓冲液 (pH 6.8) 混合, 配成其应用液. 现配现用。
磷酸盐缓冲液 (1 / 15 mol/L,pH 6.8) 配制方法如下:
a) 第一液:取磷酸氢二钠 (Na2 HPO4)9.47 g 溶于 1000 mL 去离子水中,配成 1 / 15 mol/L 溶液;
b) 第二液:取磷酸二氢钾 (KH2 PO4 )9.07 g 溶于 1 000 mL 去离子水中,配成 1 / 15 mol/L 溶液;
c) 取第一液 50 mL 加于第二液 50 ml 中混匀,即为 pH 6.8 的 1 / 15 mol/L 磷酸盐缓冲液。
二、 试验方法
2.1 受试物
固体受试物应溶解于适合的溶媒中,并稀释至适当浓度。液体受试物可直接使用或稀释至适当浓度使用。受试物应无菌现用现配,否则须确认储存不影响其稳定性。
2.2 细胞
可选用中国仓鼠肺细胞株 (V79、CHL) 或卵巢细胞株 (CHO)、小鼠淋巴瘤细胞株 (L5178Y)、人外周血淋巴细胞株 (如 TK6) 和原代培养细胞。推荐使用 CHL 或 L5178Y 细胞株。细胞在使用前应进行染色体数目稳定性和有无支原体污染的检查。汇智泰康体外微核试验试剂盒推荐使用中国仓鼠肺细胞株(CHL)。
2.3 试验方案选择
试验分为使用和不使用 cytoB 两种方案。
方案一:
在细胞经过受试物处理,有丝分裂前使用 cytoB,然后观察分析已完成一次有丝分裂的细胞 (双核细胞) 微核率。当选用人类淋巴细胞时, 建议采用方案一,因为不同来源的细胞周期不同,而且不是所有的细胞都对植物血球凝集素 (PHA) 有反应。
方案二:
不使用 cytoB,细胞经过受试物处理后观察分析细胞微核率。如果有证据表明受试物干扰 cytoB 的活性,或 cytoB 可能影响细胞的生长 (如小鼠淋巴瘤细胞株),建议采用方案二。
2.4 剂量
2.4.1 剂量设置
至少应设置 3 个检测剂量。受试物没有细胞毒性时,从最高剂量往下设至少 2 个剂量,一般情况下间隔系数可为 2~3;有细胞毒性时,其剂量范围应涵盖从 55% 士 5% 的细胞毒性到几乎无细胞毒性。
2.4.2 最高剂量的选择
决定最高剂量的因素是细胞毒性、受试物的溶解度以及 pH、渗透压。
受试物有细胞毒性时,最高剂量应能引起 55% 士 5% 的细胞毒性;如果没有细胞毒性或沉淀,最高剂量应是 5 μL/mL、5 mg/ml 或 10 mmol/L。
对溶解度较低的物质. 当达到最大溶解浓度时仍无毒性,则最高剂量应是在最终培养液中溶解度限值以上的一个浓度。在某些情况下,应使用一个以上可见沉淀的浓度,溶解性可用肉眼鉴别,但沉淀不能影响观察。
2.4.3 细胞毒性的确定,
在 S9 存在和不存在两种条件下依据细胞完整性和生长情况的指标来确定细胞毒性。
2.4.4 阳性对照
阳性对照物包括染色体断裂剂和非整倍体剂。加 S9 时,断裂剂可以选用环磷酰胺和苯并 (a) 芘;不加 S9 时,断裂剂可以选用阿糖胞苷、丝裂霉素 C、甲磺酸甲酯和 4 -硝基喹啉;非整倍体剂只用于不加 S9 时,可以选用秋水仙素和长春新碱。
如果短期处理试验方案在 S9 存在和不存在两种条件下都选用断裂剂作为阳性对照,那么长期处理试验方案应该选用非整倍体剂作为阳性对照。如果选用的细胞本身具有代谢能力,则不需要另外添加 S9,阳性对照应该同时使用断裂剂和非整倍体剂。
2.4.5 阴性对照
溶媒必须是非致突变物,不与受试物发生化学反应,不影响组胞存活和 S9 活性。首选溶媒是培养液 (不含血清) 或水。使用水作为溶媒时其体积不应大于总体积的 10%。DMSO 也是常用溶媒,但终浓度不应大于 1%。
2.4.6 空白对照
如果没有文献资料或历史资料证实所用溶媒无致突变作用时应设空白对照。
2.5 试验步骤
2.5.1 细胞准备
将一定数量的细胞接种于培养皿 (瓶) 中,以收获细胞时,培养皿 (瓶) 的细胞未长满为标准,贴壁细胞一般以长到 85% 左右为佳。
2.5.2 受试物处理
2.5.2.1 应用方案一,吸去培养液,用磷酸盐缓冲液洗细胞,加入无血清培养液及一定浓度的受试物 (需代谢活化者同时加人 S9 mix),置于培养箱中 3 h~6 h;结束后吸去含受试物的培养液,用 PBS 洗细胞,加人含 10% 血清的新鲜培养液和 cytoB,继续培养 1.5 个~2.0 个正常细胞周期后收集细胞。
对于淋巴细胞,最有效的方法是在有丝分裂原 (如 PHA) 刺激后 44 h~48 h 开始受试物处理,这时细胞开始进入分裂周期。
如果 3 h~6 h 短期处理的试验结果为阴性或不明确时,需要进行无 S9 的长期处理试验,用 cytoB 和受试物处理细胞 1.5 个~2.0 个正常细胞周期,在处理结束后收集细胞。
如果已知或怀疑受试物 (如核苷类物质) 可能影响细胞周期 (特别是 P53 活性细胞),则细胞收获时间应该再延长 1.5 个~2.0 个正常细胞周期。
2.5.2.2 应用方案二,与 2.5.2.1 处理方法相同,只是不加 cytoB。
2.5.3 收获细胞与制片
每次培养都应单独收获细胞和制片,如果细胞混合液的分散度良好则不需要进行低渗处理。
2.5.3.1 消化
贴壁细胞用 0.25% 胰蛋白酶溶液消化,待细胞脱落后,加入含 10% 胎牛或小牛血清的培养液终止胰蛋白酶的作用,混匀,放人离心管以 800r/min~1 000r/min 的速度离心 5 min,弃去上清液。悬浮细胞不需要消化,直接离心。.
2.5.3.2 低渗
加入 0.075 mol/L 氯化钾溶液 2 mL,用滴管将细胞轻轻地混匀,放人 37°C 细胞培养箱中低渗处理 1 min~5 min.
2.5.3.3 固定
加入 2 mL 固定液,混匀后固定 5 min 以上,以 800 r/min~1 000 r/min 的速度离心 5 min,弃去上清液。重复一次,弃去上清液。
2.5.3.4 滴片
加人数滴新鲜固定液,混匀。用混悬液滴片,自然干燥。
2.5.3.5 染色
推荐用姬姆萨染色 (5% ~10% 姬姆萨染液,15 min~ 20 min),,也可用 DNA 特异性荧光染料 (如: 吖啶橙或 Hoechst 33258)。
如果需要区分染色体断裂剂和非整倍体诱变剂,可用荧光原位杂交 (FISH) 或引物原位标记等方法。
2.5.4 阅片
2.5.4.1 微核的判断标准:微核一般为圆形或椭圆形,直径不超过主核的 1 / 3;与主核在一个焦点平面上,与主核的颜色、结构特征及折光性一致;与主核之间没有核物质相连,可以和主核有边界的重叠,但能看清各自的核膜。
2.5.4.2 应用方案一,每个剂量组至少分析 2000 个双核细胞,计算微核细胞率 (一个双核细胞不论含有几个微核,都只算作一个含微核细胞)。如果单次培养可供计数的双核细胞数少于 2000,则应采用多次细胞培养或平行培养。对不规则的双核细胞 (如两个核大小相差悬殊) 和多于两个核的细胞不进行分析。
2.5.4.3 应用方案二,每个剂量组至少分析 2 000 个细胞,计算微核细胞率。如果单次培养可供计数的细胞数少于 2000,则应采用多次细胞培养或平行培养。
三、数据处理和结果判定
3.1 数据处理
数据按不同剂量列表,指标包括细胞毒性、观察细胞数、含微核细胞数及微核细胞率。受试物各剂量组与空白对照组、阴性对照组 (溶媒对照组)、阳性对照组的微核细胞率用适当的统计学方法 (如 X2 检验) 进行处理。
3.2 结果判定
下列两种情况可判定受试物在本试验系统中为阳性结果;
a) 受试物引起微核细胞率的增加具有统计学意义,并与剂量相关;
b) 受试物在任何一个剂量条件下,引起的微核细胞率增加具有统计学意义,并有可重复性。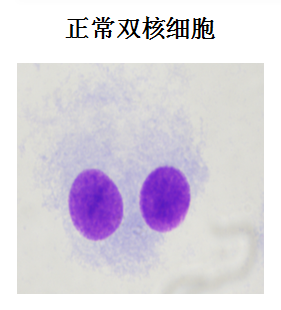

四、试验解释
阳性结果表明受试物在该试验条件下可引起所用哺乳类细胞染色体损伤,微核细胞率增加。阴性结果表明在该试验条件下受试物不引起所用哺乳类细胞染色体损伤。评价时应综合考虑生物学和统计学意义。
体外微核试验试剂盒
北京汇智泰康针对体外哺乳类细胞微核试验开发体外微核试验试剂盒,本试剂盒提供了进行体外哺乳类细胞微核试验所需的主要试剂和细胞,快速检测受试物是否有导致染色体断裂和诱发非整倍体的情况,从而评价受试物的遗传毒性,试剂盒的使用可以大大节约实验人员的准备时间。
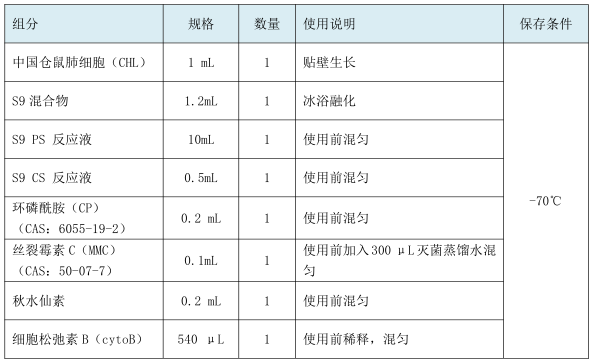
【产品使用说明】
1、细胞复苏
收到试剂盒后,请尽快复苏细胞。
从- 70 冰箱取出细胞,于 37℃ 水浴融化,离心,弃上清,用含 10% 牛血清 RPMI 1640 培养液(RPMI- 10)中重悬细胞后,再次离心;弃上清,用 RPMI- 10 重悬后接种于细胞培养瓶,于 37℃ 二氧化碳培养箱中培养,后期细胞传代比例为 1:3。
2、细胞准备
将处于对数生长期,贴壁生长良好的细胞用胰蛋白酶(Trypsin-EDTA)消化处理制成细胞悬液,5 mL/瓶接种于 25 cm2 细胞培养瓶中,于 37℃、5% 二氧化碳培养箱中加湿培养约 24 h- 48 h。
3、染毒处理
吸去培养瓶中培养液,加入一定浓度的受试物、S9 混合液(不加 S9 混合液时,需用培养液补足)以及一定量不含血清的培养液,于培养箱中处理 3 h。弃去处理液,使用 PBS 洗涤细胞 2~3 次,换液后,按 1% 的比列加入细胞松弛素 B(如 4.95 mL RPMI- 10 + 0.05 mL cytoB)。具体试验方案见下表:
4、收获细胞及制片
用胰蛋白酶溶液消化细胞,加入 0.075mol/L 氯化钾溶液进行低渗处理,固定液(甲醇:冰醋酸 = 3:1,可适当调整冰醋酸浓度,但不宜过大)进行固定并滴片,用吉姆萨染液染色,中性树胶封片,并于油镜下进行阅片,每处理组计数 500 个细胞中的增值指数 CBPI 和细胞复制指数 RI,计算出细胞毒性;每一剂量组应分析不少于 2000 个核型相差不大的双核细胞,计算微核率。
【注意事项】
实验前请自行准备 RPMI 1640 培养液、牛血清、细胞培养瓶、0.075mol/L 氯化钾溶液、甲醇、冰醋酸、吉姆萨染液、胰蛋白酶、24 孔细胞培养板、灭菌枪头、无菌移液管、二氧化碳培养箱、振荡器、15、50 mL 离心管等,所有耗材需做无菌处理。
汇智泰康针对不同遗传毒性实验,开发了遗传毒性 Ames 试剂盒,微量波动 Ames(Mini-Ames)试验试剂盒,体外染色体畸变试剂盒,体外微核试验试剂盒,TK 基因突变试剂盒,HGPRT 基因突变试剂盒,彗星试验试剂盒,试剂盒已配置好整个试验主要成分,可以大大减少遗传毒性实验的前期准备工作,试剂盒各成分均经过严格的质量检测,产品稳定性好。公司从 2013 年开始研发遗传毒性检测试剂盒,产品经中国食品药品检定研究院、中国疾病预防控制中心、国家食品安全风险评估中心、各级食药监系统、各级疾控系统,药物研发企业,各大高校科研机构等多家单位使用及验证。
● 遗传毒性 Ames 试验试剂盒
● 微量波动 Ames(Mini-Ames)试验
● 体外染色体畸变试剂盒
● 体外微核试验试剂盒
● TK 基因突变试验试剂盒
● HGPRT 基因突变试验试剂盒
● 彗星试验试剂盒