做 ChIP 的心得体会
丁香实验
做 ChIP(Chromatin Immunoprecipitation)已经几个月了,虽时间不长,但深刻体会细节决定成败,这里就把自己认为值得注意的细节总结如下:
1、cell counting:尽量做到准确,会影响 input 结果。
2、cross link:甲醛的终浓度是 1%,这个基本所有的 protocol 上都会强调。
3、resuspend cells with SDS:一定要选用小的 tip 头,在液面下吹打,否则很容易产生气泡,后面的 sonication 就麻烦了。
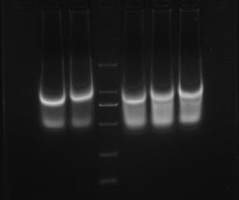
4、sonication:ChIP 中最重要的一部分,合适的条件要自己摸索,可以一次尝试不同次数的 sonication,然后建议采用 EZ-ChIP 上推荐的方法看看 sonication 的效果如何。
5、加入 salmon sperm DNA/Protein A or G 之前要先混匀,因为salmon sperm DNA 是很粘稠的物质,若不混匀,后面你会发现 beads的量不一样,自然也会影响实验的结果。
6、wash 的时候前面几个步骤可以不用洗的太干净,但最后一个要尽量吸干净,必要时可用 gel loading tips 吸。
7、含 beads 的 samples 离心时,有的 protocol 上推荐是 1000rpm,45 秒,但可以根据情况调整,但要注意转速不能太快防止beads 破碎。(当然如果采用的是 magnetic 的 beads 就不存在这个问题)
8、reverse crosslink 可以是 65°4 个小时,也可以 overnight。
9、reverse crosslink 后的在进行下面步骤之前建议先离心,把蒸发到离心管盖子上的部分离下来。
10、每次行 real time PCR 之前都要把 sample 离心保证取样的准确。
11、1~10ul 的取 3ul 以上才比较准确,所以考虑好自己 PCR 反应体系的配置。
12、一个 ChIP 一般需要 3~4 天的时间,其中有几个步骤是可以停下来的:
1)细胞收集:用含蛋白酶抑制剂的 PBS 洗涤离心,去上清的细胞收集液可置 -80° 冻存;
2)用 SDS 重悬细胞后可置 -80° 冻存;
3)sonication 结束,离心后的上清置新的离心管后可 -80° 冻存;
4)reverse cross-link 后的标本可 -80° 冻存。
13、agarose beads 的 wash 过程中以及后面的 DNA 提取过程中乙醇的 wash,可以用细胞室的那种吸引器,接上 200ul 的 tip 头吸,这样会节省很多时间(每个实验室情况可能不一样)。
14、DNA 提取后建议用水溶解 DNA,因为 TE buffer 里的 EDTA 可能会影响 PCR 反应体系中的 Mg2+。
15、溶解 DNA 的水量可以根据 PCR 反应体系的要求适当调整。