手把手教你染色体步移
丁香园
染色体步移是一种常用的克隆已知基因旁侧序列的技术。基因的表达调控已成为分子生物学研究热点之一,启动子是基因表达调控的重要顺式元件,启动子的克隆对于研究基因表达调控,构建基因工程载体,表达目的蛋白有着重要的意义。
启动子克隆的方法很多,常见的扩增启动子或已知序列末端旁侧的核苷酸序列的方法有两种:
方法一 酶切加接头
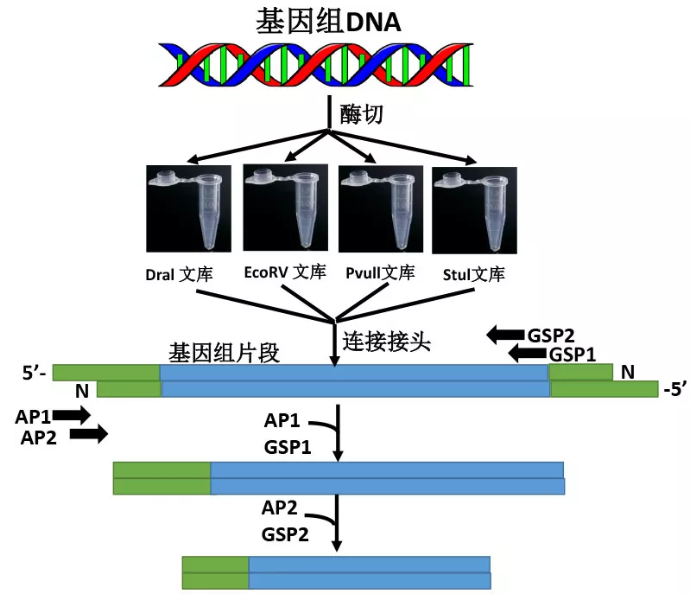
1 大量提取基因组 DNA
(1)取样品 100 mg,置于 1.5 mL EP 管中,加入 500 uL 裂解液(56 °C),用研磨棒充分匀浆。
(2)加入 350 uL 苯酚(pH=8.0)和 300 uL 氯仿,颠倒混匀,静置 5 min,14 000×g 离心 10 min。
(3)取上清至新 Ep 管中,加入 270 ul 苯酚和 270 ul 氯仿混匀,静置 5 min,14 000×g 离心 10 min。
(4)取上清至 EP 管中,加入 270 ul 苯酚和 350 ul 氯仿,轻混,静置 5 min,14 000×g 离心 10 min。
(5)取上清至新的 EP 管,加入 500 ul 苯酚,静置 5 min,14 000×g 离心 10 min。
(6)去上清液(约 400 uL)至新管,加入 50 ul 7.5 M 的 NH4Ac 和 800 ul 冰乙醇(-20 °C)存放,置于冰上 15 min,使 DNA 充分沉淀,14 000×g 离心 5 min。
(7)弃尽上清,置于室温晾干,加入 50~100 ul 无菌水,待 DNA 全部溶解后,加入 1 ul RNase(20 ug/ul),37 °C 孵育 1 小时,于 -20 °C 保存。
(8)取 5 ul 的 gDNA 进行 1.5% 琼脂糖凝胶电泳,以鉴定其完整性,并在分光光度计测其浓度,A260/280 的数值应在 1.8~2.0 之间,并将其浓度调整至 100 ng/ul,-20 °C 保存。
2 Genome-walking 文库建立
(1)取 4 个 1.5 mL EP 管,做好标记(Dra I、Stu I、Pru II 和 EcoR V),分别依次加入:

(2)轻弹混匀,勿涡旋,以免 DNA 断裂。37 °C 孵育 2 h。轻弹混匀,重新置于 37 °C 过夜(16~18 h)。
(3)从每个反应管中分别取 5 ul 酶切产物,进行 1.5% 琼脂糖凝胶电泳,并取 5 ul 的纯化基因组作为对照。
3 酶切基因组 DNA 的纯化
(1)将上述酶切产物中加入等体积的苯酚:氯仿:异戊醇(体积比 25: 24: 1),混匀后 12 000 rpm 离心 10 min,取上清。
(2)加入等体积氯仿:异戊醇(体积比 24: 1),混匀,12 000 rpm 离心 10 min,取上清。
(3)加入 1/10 体积的 3 mol/L NaAc(pH 5.2)、2 倍体积预冷的无水乙醇,12 000 rpm 离心 10 min,沉淀用 70% 乙醇漂洗 2 次后,风干。
(4)用适量的 1×TE 溶解后于 –20 ℃ 储存。
4 连接
人工合成接头引物:
AdaporA 5'-GTAATACGACTCACTATAGGGCACGCGTGGTCGACGGCCCGGGCTGGT -3'
AdaptorB 5'-PO4- ACCAGCCC-H2N-3'
合成接头:
两个接头的浓度均为 50 µmol/L。
将 AdaporA 和 AdaporB 各取 10 µL 混合均匀,80 ℃ 变性 10 min,室温冷却 1 h,制作成接头,-20 ℃ 保存备用。
分别将经不同内切酶消化的 DNA 和合成的接头在 16 ℃ 条件下连接过夜。连接体系为:

70 ℃ 保温 5 min 结束连接反应。加入 72 μL TE 缓冲液(pH 8.0)稀释连接产物,并作为模板进行扩增。
5 PCR 反应体系和扩增程序
GSP 设计要点:
引物长度:26~30 bp(如果引物的 Tm 值很高,引物的长度也不要少于 26 bp,推荐使用 27bp)
GC 含量:40~60%
引物不能向后折叠形成发卡结构,3' 末端序列的引物不能与接头引物 3' 末端形成氢键
3' 末端不能有连续超过 3 个 G 或 C
将用于 5' 端延伸的基因特异性引物以及 3' 端延伸的基因特异性引物分别与接头引物 AP1(5'-GTAATACGACTCACTATAGGGC-3')和巢式接头引物 AP2(5'-ACTATAGGGCACGCGTGGT-3')组合进行 nested PCR 扩增。
采用 25 μL 扩增体系:10×LA buffer 2.5 μL,dNTP Mixture(2.5 mmol/L)2.0 μL,接头(adaptor primer)(10 μmol/L)2.0 μL,基因特异引物(10 μmol/L)2.0 μL,接头 - DNA 连接产物(adaptor DNA)1.5 μL,LATaq DNA 聚合酶(5 U/μL)1.5 U,dd H2O 补足 25 μL。将首轮扩增产物以 TE 缓冲液(pH 8.0)稀释 10 倍作为 Nested PCR 的模板。
扩增程序:94 ℃ 25 s,72 ℃ 4 min,7 个循环;94 ℃ 25 s,67 ℃ 4 min,32 个循环;67 ℃ 7 min,4 ℃ 保存。
方法二 TAIL-PCR 技术
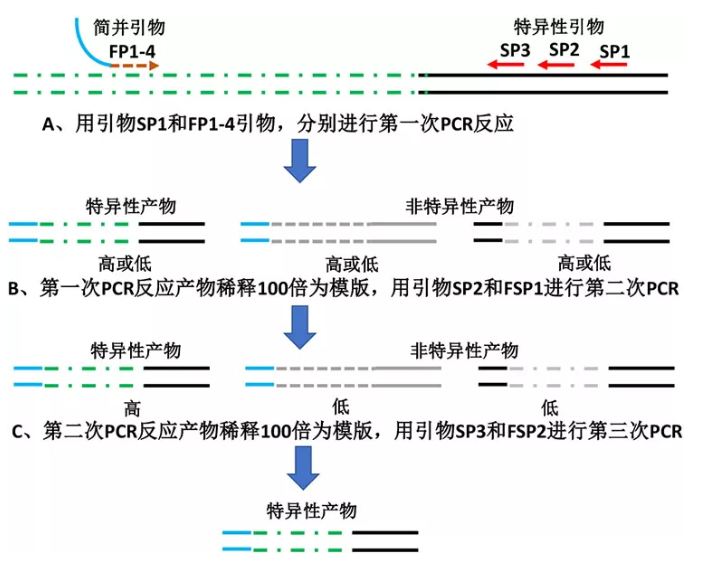
1 基因组 DNA 提取(同上)
2 TAIL-PCR 引物设计
根据已知的基因组 DNA 片段序列,以待扩增的 5' 末端或 3' 末端方向设计 3 条嵌套的特异性引物,引物 SP2 设计位置在 SP1 内侧,SP3 位于 SP2 内侧,这 3 条引物分别为第 1 至第 3 轮反应的下游引物。引物 FP1 到 FP4 为上游简并引物,用于第 1 轮扩增的 4 个平行反应;FSP1 和 FSP2 分别作为第 2 和第 3 轮扩增反应的上游引物或下游引物(表 1)。SP1-3 设计的要点同上。
表 1 用于 TAIL-PCR 扩增的引物

3 TAIL-PCR 扩增
(1)TAIL-PCR 反应体系
Pre-amplification(20 ul):10×Ex Taq Buffer(Mg2+ Plus)2.0 ul, dNTP Mix(各 2.5 mM)2 ul,任 1 种 SP1 引物(20 uM)1 ul,引物 FP1-4(10 uM)1 ul,DNA 模板 1 ul,Ex Taq 酶(5 U/ul)0.2 ul,dd H2O 补足至 20 ul。
Primary TAIL-PCR(25 ul):10×Ex Taq Buffer(Mg2+ Plus)2.5 ul, dNTP Mix(各 2.5 mM)2 ul,引物 SP2(10 uM)1 ul,引物 FSP1(10 uM)1 ul,DNA 模板(预扩增产物稀释 50 倍)1 ul,Ex Taq 酶(5 U/ul)0.25 ul,dd H2O 补足至 25 ul。
Secondary TAIL-PCR(25 ul):10×Ex Taq Buffer(Mg2+ Plus)2.5 ul, dNTP Mix(各 2.5 mM)2 ul,引物 SP3(10 uM)1 ul,引物 FSP2(10 uM)1 ul,DNA 模板(上一轮扩增产物稀释 10 倍)1 ul,Ex Taq 酶(5 U/ul)0.25 ul,dd H2O 补足至 25 ul。
(2)TAIL-PCR 反应程序(表 2)
表 2 TAIL-PCR 反应程序
Table 2 Thermal conditions for TAIL-PCR

今天就先介绍到这里啦,没有说清楚的地方希望大家留言交流。你的支持就是我最大的动力。





