染色质免疫共沉淀(Chromatin immunoprecipitation,ChIP)是一种用于研究目的蛋白在染色质上定位的技术。ChIP 的原理是通过甲醛处理细胞固定 DNA 和蛋白,然后提取染色质,使用超声或酶解将染色质剪切成小片段。
之后使用结合在染色质的目的蛋白或组蛋白修饰特异性抗体富集 DNA 片段。富集的 DNA 片段可以通过 PCR,DNA 芯片或测序进行分析。虽然原理看起来很简单,但 ChIP 是一项非常具有挑战的技术,很多因素都可能导致实验失败。
如何选择 ChIP 抗体?
抗体的质量是 ChIP 成功非常关键的因素,只有能够识别染色质状态下的天然蛋白构象的高质量的抗体才能用于 ChIP 实验。
想要知道一个抗体是否适合用于 ChIP 实验其实很简单。正规厂家的说明书都会有一项是说明应用范围的。挑选抗体时优先选择应用范围有「ChIP」并有相关数据的,说明抗体经过检测,可以用于 ChIP。如果找不到这样的抗体可以优先挑选经过 IF、IP、ICC 验证的,之后自己进行验证或委托外包服务公司进行验证。
除此之外,在做组蛋白修饰 ChIP 时,因为各种组蛋白修饰之间差异非常小,这对抗体特异性提出了更高的要求。如果抗体特异性不够高导致发生交叉反应,很可能产生假阳性或假阴性结果。针对这一问题,可以使用包括 384 种不同修饰的组蛋白芯片检测自己生产组蛋白抗体特异性,保证组蛋白抗体的高特异性。
没有特异性抗体怎么办?
如果目标蛋白没有商业化的抗体可选,一种方式是定制抗体,之后进行 ChIP 验证。这种方式的优点是检测到的是内源性的蛋白,结果反映的一定是体内真实的蛋白和 DNA 相互作用。但定制抗体成本较高,并且 ChIP 验证过程失败率高达 75%。
另一种方式是给目标蛋白加标签,通过标签检测目标蛋白。AM-Tag 标签是专门针对 ChIP 设计的蛋白标签。通过质粒构建加到目标蛋白 C 端。转染进入细胞之后通过特异性 AM-tag 抗体进行 ChIP。Active Motif 实验室通过构建雌激素受体(ER)加 AM-tag 标签质粒检测 AM-tag ChIP 效果,结果数据与发表文章中使用 ER 抗体检测内源性蛋白结果一致。

没有足够的起始样本怎么办?
ChIP 是一项富集技术,不是纯化方法。大部分我们感兴趣的蛋白或组蛋白修饰分布在整个基因组,只是不同区域的富集度不同。因此,有意义的结果需要高效的富集。
传统的 ChIP 实验需要至少两百万细胞作为起始材料,这对于有些珍贵细胞样本是非常困难的。解决这个问题的关键是通过 ChIP 的 buffer 及条件优化,降低非特异性的背景,实现最优的信噪比。
针对这个问题,一方面通过 buffer 条件优化,提供高灵敏 ChIP 试剂盒,最少可用 1000 个细胞进行 ChIP 实验。另一方面,也提供低细胞量的 ChIP-Seq 服务,对于高丰度目标蛋白(如组蛋白修饰)仅需 10000 个细胞;对于低丰度目标蛋白(如转录因子),仅需 50000~500000 个细胞。
如何对 ChIP-seq 进行精确定量?
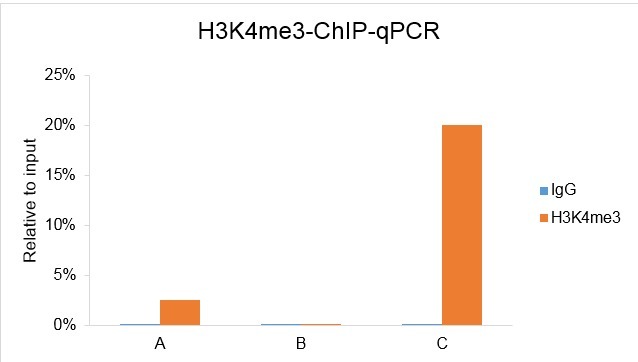
我们的研究团队在对不同样本的 H3K27me3 ChIP-seq 数据比较时,发现了一个有意思的问题。通过 H3K27me3 甲基转移酶 EZH2 的抑制剂处理细胞以后,免疫印迹检测结果表明,H3K27me3 整体水平显著下降。ChIP-qPCR 也检测到很多位点的 H3K27me3 水平有明显下调。
但用常规的 ChIP-seq 分析方法比较,并不能检测到 H3K27me3 水平的下降。造成这个结果的原因在于在标准的 ChIP-seq 实验过程中,文库构建需要的 PCR 扩增以及常规数据分析时对整体数据量的校正掩盖了样本间数据量的差异。
针对这一问题,Active Motif 凭借多年的 ChIP-seq 服务经验成功研发出「Spike-In」校正策略。标准的 ChIP 反应是使用样本染色质和抗体建立的。在「Spike-in」校正体系中,果蝇(Dropsophila)「Spike-in」染色质和识别果蝇染色质的抗体也被加入到反应体系中。因为果蝇的基因组和人的基因组同源性很低,在做测序分析的时候,它就可以作为内参,对整个 ChIP-seq 起到矫正作用。


如何检测染色质上蛋白之间的相互作用?
RIME(Rapid Immunoprecipitation Mass spectrometry of Endogenous proteins)是一项 ChIP 和质谱分析相结合的技术。非常适合用于鉴定转录辅助因子和染色质相关蛋白的相互作用。传统的鉴定蛋白相互作用的方法是 IP 之后进行质谱分析。与 IP 方法不同,RIME 使用的起始材料经过交联,主要检测的是染色质上蛋白之间的相互作用。


怎么检测同一基因组位置的两个蛋白质或不同的组蛋白修饰?
当进行 ChIP 实验去解码组蛋白编码时,证明两个不同的蛋白质或者组蛋白修饰占据同一个核小体位点是非常有意义的。或者,您也许需要确定一个蛋白质和特定的组蛋白修饰是否在同一个调控元件。
Sequential ChIP(也叫做 Re-ChIP)是一项使用两个不同抗体进行连续 ChIP 反应的技术,第一次 ChIP 反应之后使用特殊 buffer 洗脱沉淀的染色质以避免第一个抗体对后续 ChIP 的影响。之后加入第二个不同的抗体进行 ChIP。通过两个不同抗体和两次 ChIP 反应,得到两个蛋白或不同组蛋白修饰所在的同一基因组 DNA 片段。
ChIP 能做 RNA 和蛋白质相互作用吗?
有证据显示 RNA 导向过程在介导染色质结构和表观遗传记忆有重要作用。从染色质中纯化的核酸含有 2~5% RNA;这些 RNA 是非编码的序列,在染色质结构和转录沉默中有重要作用。
然而,因为染色质的复杂度以及染色质中大量 DNA 的存在,用传统的 ChIP 技术研究这些 RNA 是很困难的。为了使基因组调控中 RNA 的功能研究变得可能,我们利用其在 ChIP 的技术研发了 RNA-ChIP 的第一代试剂盒,主要用于研究染色质中 RNA-蛋白质的相互作用。
RNA-蛋白质的相互作用用甲醛固定,染色质剪切结合 DNA 酶处理得到了可以用特异性蛋白抗体免疫沉淀的 RNA/蛋白质复合物。随后进行解交联,解交联之后的 RNA 再用 DNA 酶处理确保没有 DNA 污染。
文章来源:Active Motif(代理商优宁维)
图片来源:优宁维生物