一文读懂 CRISPR 编辑技术
解螺旋
CRISPR 基因编辑技术自问世以来,就有着其他基因编辑技术无可比拟的优势,其应用在医学科研领域后,也不断的取得喜人的成果,进而迅速风靡于世界各地的实验室。那么 CRISPR 技术如此受到科研界的青睐,到底有什么过人之处呢?本文则揭开 CRISPR 神秘的面纱,让你快速掌握该基因编辑热门技术的精髓所在。
CRISPR 原理及基本结构
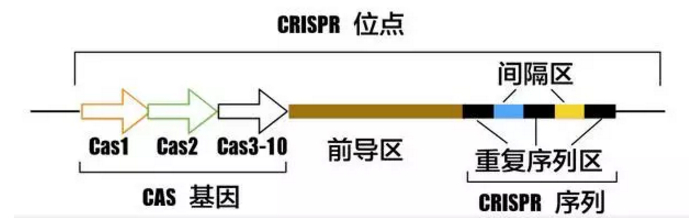
CRISPR/Cas 系统作为原核生物的免疫系统,可识别外源性遗传物质 DNA,并将其切断,沉默外源基因的表达。在该系统中,CRISPR 序列是由众多短而保守的重复序列区(repeat)和间隔区(spacer)组成的。Repeat 区含有回文序列,可形成发夹结构,而 Spacer 区则是被细菌俘获的外源 DNA 序列。其上游的前导区(leader)相当于 CRISPR 序列的启动子,此外还有一个多态性的家族基因(Cas 基因),其编码的蛋白可与 CRISPR 序列区域共同发生作用。
CRISPR 功能实现的三个阶段
第一个阶段:外源性 DNA 的采集(Foreign DNA Acquisition)
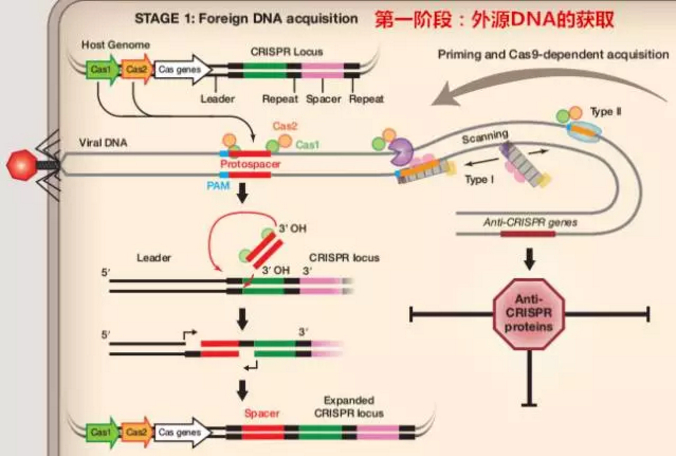
当噬菌体病毒侵入宿主细菌后,病毒 dsDNA 被注入细胞中。此时,Cas1 / 2 蛋白可识别外源 DNA 原间隔序列临近基序(PAM,通常由 NGG 三个碱基构成,N 为任意碱基),并将原间隔序列(protospacer)剪切下来。之后 Protospacer 可插入到 CRISPR 序列前导区的下游中,完成外源 DNA 的捕获。
第二阶段:crRNA 的合成(crRNA biogenesis)
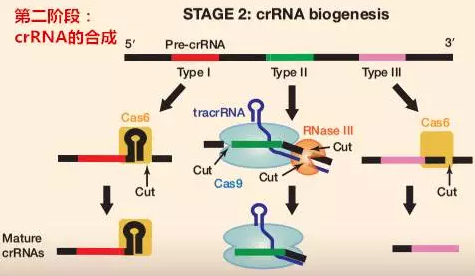
在 I 型和 III 型系统中,初始 CRISPR 转录产物(Pre-crRNA)会被 CRISPR 特异性核酸内切酶(Cas6 / Cas5d)在重复序列位点内切割形成成熟的 crRNA。在 II 型系统中,Pre-crRNA 可通过重复序列与其互补序列 transacting RNA(trancrRNA)反式结合,然后在 Cas9 存在的情况下被 RNaseIII 加工融合成一个 sgRNA。目前,II 型系统是最成熟也是应用最广的类型,而 Cas9 已经变成了在多种细胞类型和组织中靶向基因编辑的强大工具。
第三阶段:靶向干扰(Target interference)
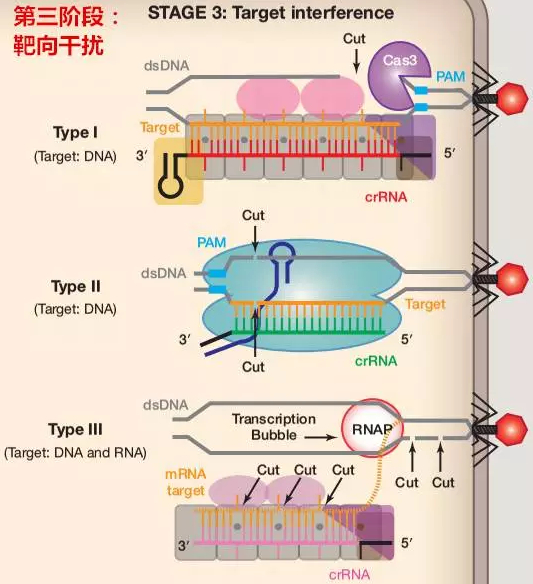
I 型和 II 型系统均可靶向含有与 PAM 和 protospacer 互补序列的 dsDNA 底物。不同的是,在 I 型系统中,通过含有多个亚型的复合物结合到 dsDNA,并招募反式核酸酶 Cas3 对 DNA 进行靶向干扰。在 II 型系统中,则通过 Cas9 蛋白的 HNH 酶活性剪切 crRNA 互补的 DNA 链及其 RuvC 活性位点剪切非互补链,促使 dsDNA 断裂。
类似于 I 型系统,III 型系统也同样依赖于具有核酸酶活性的多亚基复合物对靶向 DNA 进行干扰,但不同于 I 型和 II 型系统,III 型系统不依赖于 PAM 进行靶标位点的识别,而是通过碱基互补配对来识别靶序列并进行 DNA 的裂解。
CRISPR 的实际应用
CRISPR 系统作为一种精确的基因编辑技术,主要被应用在 DNA 编辑领域,可为疾病的靶向个性化治疗提供强大的技术支持。
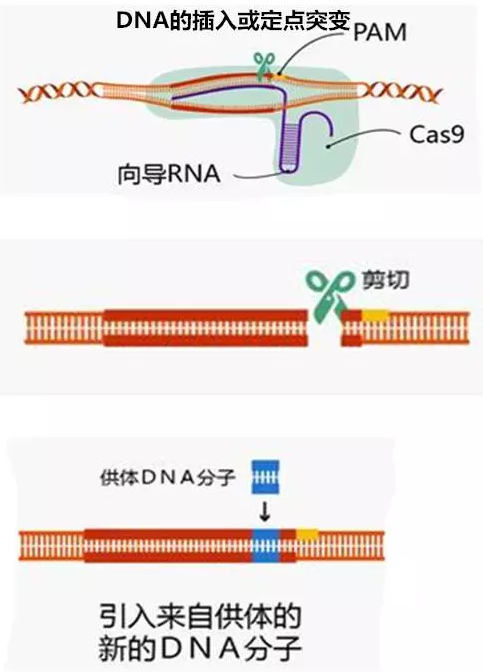
例如,可在待敲除的目的基因的上下游各设计一条向导 RNA(gpRNA1、gpRNA2),将其与含有 Cas9 蛋白编码基因的质粒一同转入细胞中。则向导 RNA 可通过碱基互补配对靶向 PAM 附近的目标序列,Cas9 蛋白会使基因上下游的 DNA 断裂。而后细胞自身存在的 DNA 损伤修复的应答机制可使 dsDNA 断裂的上下游两端的序列连接起来,从而实现了目的基因的敲除。
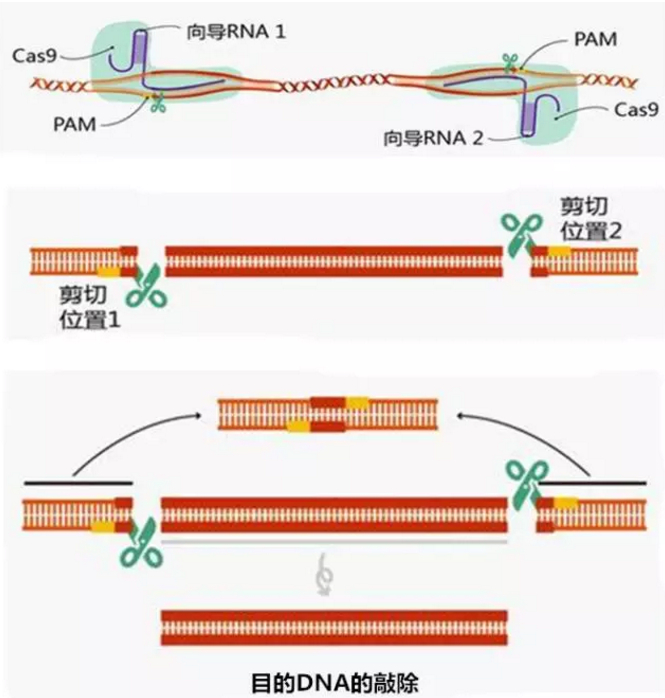
再如,可为细胞提供一个修复的模板质粒,这样细胞就可按照提供的模板在修复过程中引入片段插入或定点突变。也可对受精卵细胞进行基因编辑,并将其导入代孕母体中,可实现基因编辑动物模型的构建。