手把手教你利用 CRISPR-Cas9 系统精准敲除靶标基因
科研小助手
一、CRISPR-Cas 系统简介

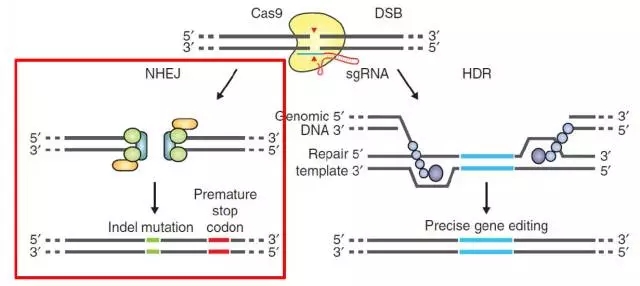
图 1 CRISPR-Cas9 系统介绍
CRISPR-Cas9 系统是一种被广泛运用的基因组编辑工具,它来源于细菌的适应性免疫系统。CRISPR-Cas9 系统包括:Cas9 酶和一个向导 RNA。 向导 RNA 作用是引导 cas9 到基因组的特异性位点上切割。如图 1 所示。目前为止,CRISPR-Cas9 系统主要有两方面应用: 基因敲除和基因敲入。基因敲除时, 一旦 DNA 的双链断裂反应(DSB)被 Cas9 切割诱导发生, 细胞会启动 NHEJ DNA 修复方式,这会造成 DNA 的删除和插入。对于基因敲入,加入一个可同源重组的 DNA 片段, 细胞会将这个一段 DNA 片段插入进基因组 。
二、两次切割介导的基因敲除
与先前的敲除策略并不一样,我们改进的这个操作系统可以将基因的删除做到可控的特定长度。我们正在基因组的一个特定的区域两边各引入一个向导性 RNA。这两个向导性 RNA 指引 Cas9 酶在这两个位点进行切割。然后切割后末端通过 NHEJ 连接上。通过这个策略,我们可以将一个基因的独立外显子或者整个基因敲除掉。如图 2 所示。
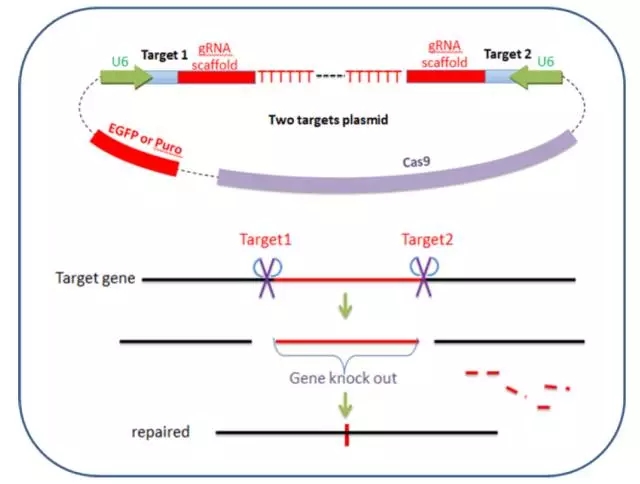
图 2 Cas9 - 2 hitKO 系统
三、Cas9 - 2 hitKO 系统中涉及到的载体
为了达到高效的敲除效率,我们在同一个载体重引入 cas9 酶和两个向导性 RNA。整个系统包括 3 个载体: PX458M ,PX459M 和 EZ-GuideXH。PX458M ,PX459M 除了含有 Cas9 和一个向导性 RNA 插入位点,还引入第二个向导性 RNA 插入位点。EZ-GuideXH 是为插入第二个向导性 RNA 的辅助性载体。PX458M 带有 EGFP 荧光标记; PX459M 带有 puromycin 抗性筛选标记。
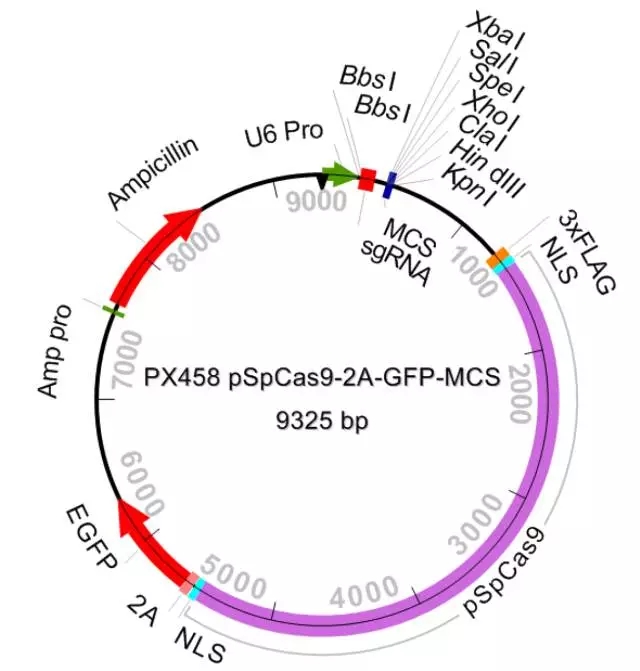
图 3 PX458M 图谱
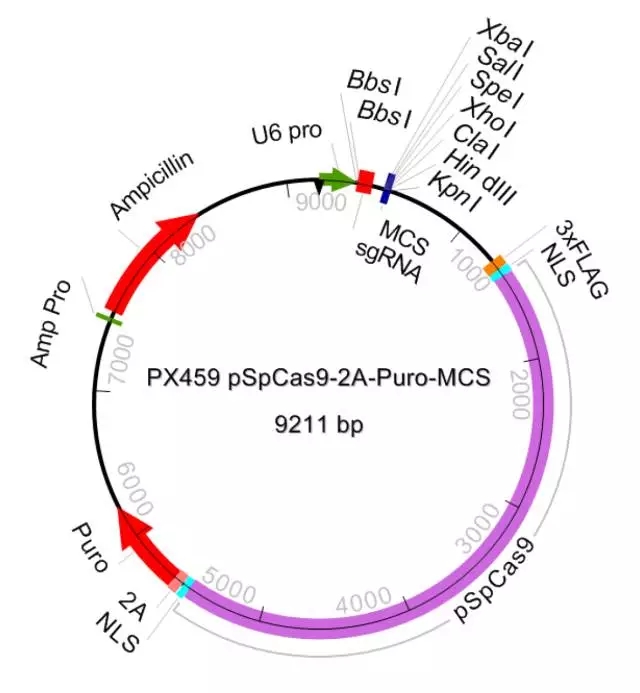
图 4 PX459M 图谱
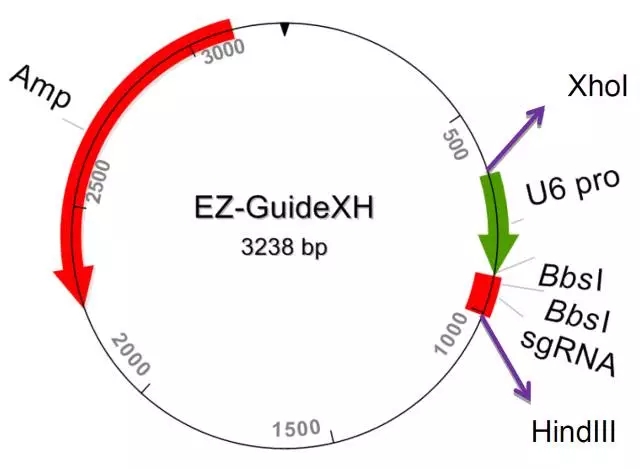
图 5 EZ-GuideXH 图谱
PX458M 和 PX459M 载体是从张峰实验室 PX458 and PX459 载体改造过来的。主要是引入了第二个向导性 RNA 插入的多克隆位点。EZ-GuideXH 来源于 EZ-T 克隆载体。
四、Guide RNA 的插入
根据张峰实验的实验操作方法, guide RNA 插入方法很简单。如图 6 所示,可以用 BbsI 消化 PX458 载体, Guide RNA 是通过引物退火方法 (20 bp 长) 引入的 BbsI 粘性末端通过 T4 DNA 连接酶插入到载体中。
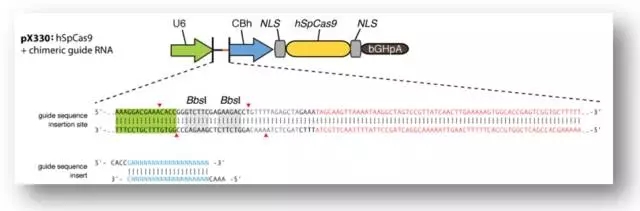
图 6 Guide RNA 的插入方法
实验流程
设计脱靶效应低的 Guide RNA 序列

基于网站的 Guide RNA 的设计
网站地址:http://crispr.mit.edu/
基本的流程如图 7。
输入最多 250 个核苷酸的基因组 DNA 序列进图 7 的 Sequence 框中,选择相应的物种。点击『submit』。
点击 Guides & offtargets.
选择得分 90 分以上的序列。序列的方向并不重要,两个方向都可以选择。
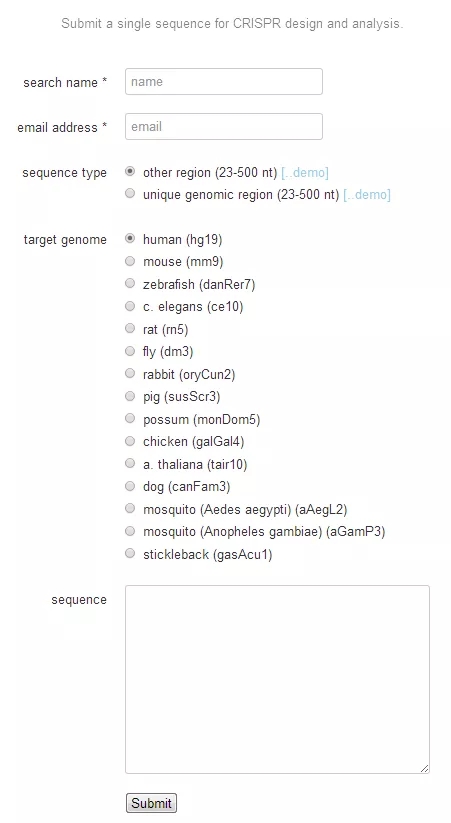
图 7 Guide RNA 设计流程
选择一对 Guide RNA 来敲除基因
敲除基因组一段序列,选择一对 Guide RNA 就显得非常重要。根据前人的实验,敲除基因 1Mb 并没什么问题。我们一般建议敲除 10Kb 以下。 选择一对 Guide RNA 的标准如下, ( 图 8 and 图 9 是两个实例)
如果目的基因比较短,在 10kb 左右 ,建议敲除全基因,甚至包括启动子。
如果目的基因比较长,建议敲除比较重要的外显子。
目的基因比较长,也可以敲除全部的启动子和部分的基因编码区
如果目的基因在发表的文献中已经报导过用传统方法敲除,我们可以用这套系统敲除同样区域。
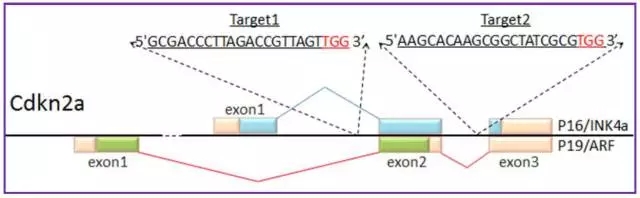
图 8 Cdkn2a 基因双 Guide RNA 设计

图 9 PTEN 基因双 Guide RNA 设计
请构建双 Guide RNA 克隆
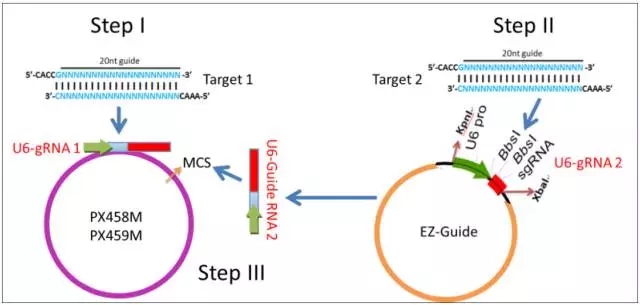
图 10 Overview of Construction
1. 合成引物
正向引物:CACC-(N)20
反向引物:AAAC-(N)20RC
如果根据张峰网站设计的 Guide RNA 第一个核苷酸不是『G』, 在 5』端补加一个『G』,因此设计好引物变成:
正向引物:CACC-G(N)20
反向引物:AAAC-(N)20RC
2. 引物磷酸化与退火

反应在 PCR 仪中进行。.
37 ℃, 30 min
95 ℃, 5 min
PCR 梯度降温到 25℃ ,速速为每秒降低 0.1℃
25 ℃, 5 min
4 ℃, 5 min
放置在冰上或者保存在负 20℃ 冰箱备用。
注意:退火这一步如果 PCR 不是梯度 PCR 仪,37 度磷酸化反应后,加热到 95 度变性后取出到室温,让它慢慢降到室温,以保证退火效果。
3. Px458M(或 PX459M) 和 EZ-Guide-XH 载体的 BbsI 酶消化

割胶回收载体,回收后的载体浓度应大于 50 ng/ul。
4. 连接反应
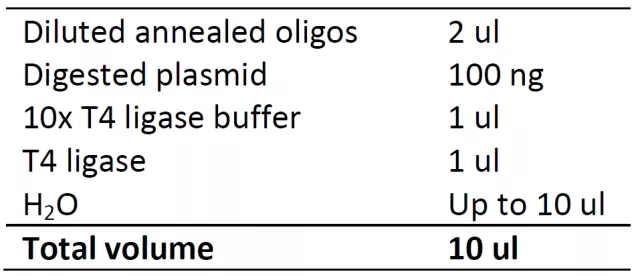
16 ℃ 连接过夜
5. 转化和鉴定阳性克隆
转化后挑取单克隆 LB 培养,然后 PCR 鉴定克隆。Px458M 或 Px459M 载体 用 Guide RNA1 的前向引物和 CAG-R 作为引物 ,PCR 产物大小为 750bp。而 EZ-GuideXH, 用 GuideRNA2 的前向引物和 M13F 作为鉴定引物, PCR 产物大小为 700bp。
鉴定好的阳性克隆应测序确认,Px458M 或 Px459M 插入 Guide RNA1 克隆用 CAG-R 测序 。而 EZ-GuideXH 插入 GuideRNA2 用 M13F 测序。
![]()
6. 将 Guide RNA2 从 EZ-GuideXH 转入到 Px458M /Px459M-Guide RNA1 得到插入双 Guide RNA 的载体 Px458M /Px459M-Guide RNA1 -Guide RNA2
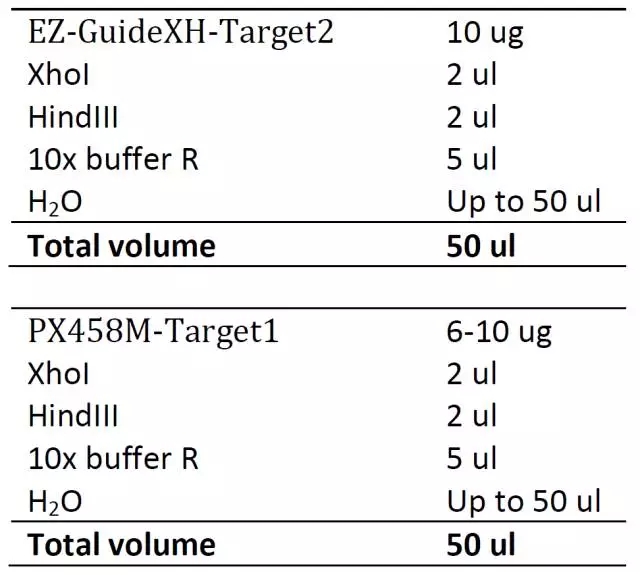
7. 割胶回收
EZ-GuideXH-Guide RNA2 消化后割取 360 bps 条带回收; PX458M/PX459M-Guide RNA1, 割取 3300 bps 大小的条带。
8. 连接反应

16 ℃ 过夜连接。
敲除效率检测
如果是敲人源细胞中的基因,我们可以在 293FT 细胞检测 系统的敲除效率,小鼠的细胞中的基因可以在 MEF 和 NIH3T3 中检测系统的敲除效率
将上述 Px458M /Px459M-Guide RNA1 -Guide RNA2 转染进 293FT 细胞中 36 - 48 小时
通过荧光显微镜和流式细胞仪检测转染效率
提取转染细胞基因组,进行基因型鉴定。引物的设计方案如图 11 所示。图 12 显示敲除 PPM1A 基因。
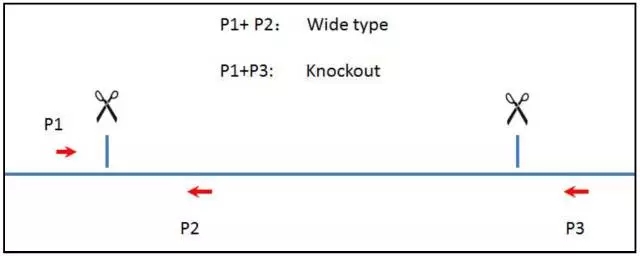
图 11. 基因型鉴定
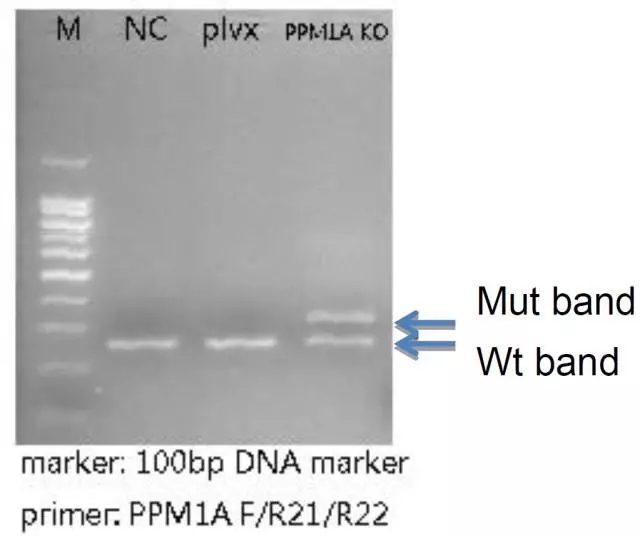
图 12 PPM1A 敲除基因型鉴定
敲除自己感兴趣细胞的基因
理论中,只要转染进 Px458M /Px459M-Guide RNA1 -Guide RNA2 载体的细胞就是基因敲出的细胞,然而我们想得到纯的基因敲除细胞株需要进行细胞单克隆化培养。对于一些细胞,单克隆化培养并不是那么容易。为了增加单个细胞的扩增,我们可以预先包被 gelatin 和条件性诱导培养液。
1. 细胞提前一天铺在 6 孔板中,确保细胞密度在 70%- 80%。
2. Px459M-Guide RNA1 -Guide RNA2 转染自己感兴趣的细胞并培养 24 小时。
3. 用 puromycin 连续筛选 3 到 4 天。 以没有转染的细胞做对照。
注意: 每种细胞筛选的 puromycin 并不完全一样,应该通过梯度实验摸索最佳浓度
4. 撤销 puromycin, 用 20% FBS 培养液培养细胞。
5. 几天后,如果有克隆发生增殖了,挑取克隆,并转移到 24 孔板中继续培养。剩下的细胞也可继续培养。
6. 24 孔板中细胞达到 30% 密度, 胰酶消化细胞,取出 80% 细胞来做基因型鉴定, 20% 细胞继续培养。
7. 14000rpm 离心收取细胞 30s。加入 20 - 60ul solution A 裂解细胞。95 ℃ 加热 10 min, 然后加入同样体积的 solution B, 涡旋震荡一下, 13000rpm 离心 0 min。取上清做基因型鉴定的模板。
8. 做完基因型鉴定后,只继续培养基因敲除的细胞克隆。
9. 当基因敲除的细胞克隆长满时,胰酶消化,进行细胞计数。以 40 个细胞每 10 毫升进行 10 倍梯度稀释。
10. 第 9 步中培养液也就是条件刺激培养液,也就是收集第 9 步中培养时间少于 24 小时的旧的培养基,在这样的培养基中加入 20% FBS 后用 0.22 ul 滤膜过滤后的细胞培养液称为条件刺激培养液。
11. 在 96 孔中,每孔加入 100 ul 除菌的 0.1% gelatin 溶液, 在 37 ℃ 细胞培养箱中放置 30 分钟以上。
12. 吸去 gelatin, 条件刺激的细胞培养液重悬细胞,按每孔 100 ul,大约 0.4 cell 加入到 96 孔每个孔中。加入 8 到 10 个孔。摇匀继续培养。
13. 4 到 5 天后在上述孔中继续加入条件刺激培养液 100 ul 每孔,不要超过 5 天。
14. 当细胞密度超过 30%, 或者克隆长得足够大,将它转移到 24 孔板中继续培养。 重复 6 - 8 步。
15. 步骤 5 中剩余的细胞长到 50% 密度时, 继续有限稀释进行单克隆化培养。也可以冻存起来留置后用。
评估脱靶效应
脱靶的情况在网址 (http://crispr.mit.edu/.) 上评估。这个网站上列举上很多潜在的脱靶位点。把这些位点通过 PCR 的方法扩增出来进行 PCR 产物测序。如果没有发现建立好基因敲除细胞株有明显的脱靶情况,那么这样的细胞可以用来进行后续的实验。