疟疾寄生虫PTEX -蛋白质输出到红细胞宿主细胞的联系
嘉宾:苏·凯斯(牛津大学)和保罗·霍罗克斯(基尔大学)为探索恶性疟原虫的生物学特性而建立的健全的遗传研究体系远远落后于酵母和果蝇等模式生物。然而,在《自然》杂志最近的两篇背对背对的报道中,三种新的(至少是疟原虫!)条件表达敲除系统被用于探索输出蛋白(PTEX)的疟原虫转座子在红细胞内生长和分裂过程中对人红细胞宿主的修饰作用。
红细胞内发育(裂殖)需要寄生虫向宿主细胞输出数百种蛋白质,以促进宿主细胞内的成功定殖、适应和增殖——其中有几种蛋白质对疾病的病理生理学至关重要。由于寄生虫生活在一个寄生的液泡(PV)中,它还必须将一个蛋白运输复合体出口到PV膜中,以确保出口到宿主细胞质内外——这是PTEX。已知PTEX的关键成分,以及疟原虫出口元件(PEXEL)基序在标记PV膜外出口蛋白中的作用(见下图和最近的一篇综述文章)。然而,这些过程的重要性被证明是一个重大的障碍,更复杂的功能研究时,唯一可用的分子工具是直接敲除。de Koning-Ward (Deakin大学,澳大利亚)和Goldberg(华盛顿大学,美国)的研究小组利用条件和可测定的方法抑制关键PTEX成分的表达,为PTEX在含有PEXEL和PEXEL阴性的输出蛋白(PNEPs)的输出中的作用提供了令人信服的证据。
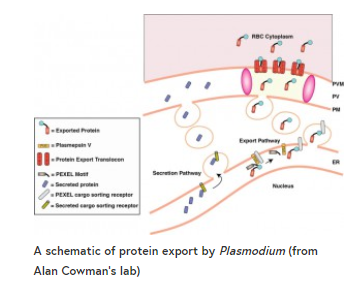
PTEX转位蛋白包含一种热休克/伴侣蛋白,HSP101,位于蛋白复合物的功能中心——在这里,它负责打开蛋白,然后穿过由EXP2形成的孔洞。Beck等人将HSP101融合到一个由甲氧苄氨嘧啶(TMP)稳定的二氢叶酸还原酶失稳域(DDD)中,发现这些被操纵的寄生虫需要TMP(相当于稳定的HSP101)的存在才能生存,而在该阶段特异性去除TMP会导致生长停滞。这适用于早期无性和早期有性阶段的寄生虫,并通过添加TMP逆转了这一效果。在环期,HSP101的不稳定阻碍了PEXEL蛋白的出口,最终目的地是红细胞胞浆和细胞膜。重要的是,他们还表明,HSP101功能的下调也阻止了PNEP的出口——证明了PTEX的作用,在出口显然是所有种类的寄生虫出口蛋白的中心环节。
HSP101在年轮后期的失稳提供了从这一阶段开始输出的蛋白。重要的是,PNEP变异抗原/毒力因子P. falciparum红细胞膜蛋白1 (PfEMP1)的输出被阻断。众所周知,PfEMP1向红细胞表面的运输需要其他输出蛋白,因此作者提醒说,他们不能明确指出PTEX直接参与了PfEMP1自身的运输。作者还表明,失稳的HSP101蛋白极大地减少了与PTEX复合物其他成员(EXP2和PTEX150)的相互作用,表明PTEX复合物的整体完整性是高效运作所必需的。
在小鼠疟疾模型中,Elsworth等人使用无水四环素(ATc)调节的激活因子,有条件地降低了P. berghei中HSP101的表达。抑制了P. berghei的生长,减少了抗原向感染红细胞表面的输出。在HSP101敲除寄生虫中,两种通常定位于红细胞胞浆的含有P. berghei的pexel蛋白和一种定位于红细胞膜的特定PNEP的出口被阻断。在恶性疟原虫中,他们使用可诱导的glmS核酶系统来降低PTEX150的表达,PTEX150是PTEX的一个预测成分。当葡萄糖胺诱导时,核酶降解标记的mRNA。可滴定的ptex150 -敲除寄生虫在滋养体早期阶段表现出不同的进展,但没有进一步的进展。类似地,PTEX150的中断会阻止PEXEL和PNEP蛋白(包括PfEMP1)的输出。
总之,这些研究很好地证明了新的分子工具在探索PTEX作为转运蛋白的功能方面的应用,这些转运蛋白对红细胞内的生存和发育至关重要。现在的挑战仍然是阐明输出机制的细节和额外的PTEX附属蛋白的作用。尽管如此,这种蛋白质输出的潜在联系,对寄生虫的发展和病理至关重要,作为一种新的药物靶标,将意味着我们将在未来几年里定期从PTEX社区听到更多的消息!
<link />