检测细胞增殖的方法很多,MTT、CCK8、BrdU 等等,你知道细胞可以 CFSE 染色用流式来检测细胞增殖么?好啦,不知道的同学搬好小板凳排排坐啦!
CFSE 是一种荧光染料,脂溶性高,易进入细胞,可以与胞内氨基酸发生不可逆的结合,在细胞的分裂过程中能够进入子代细胞,同时荧光强度也变为母细胞的一半,可用流式或荧光显微镜对其进行分析。
下面我们就开始动手,用流式来检测脾淋巴细胞的增殖。
— 先准备一些试剂 —
ConA 储存液:用双蒸水配置终浓度为 1 mg/ml(200×)
CFSE 储存液:用 DMSO 配置终浓度为 5 mM 的 CFSE 溶液(1000×)
RPMI 1640 完全培养基:RPMI 1640 培养基 + 10% 血清 + 1% 双抗
☟☟☟
— 实验正式开始 —
1. 脾淋巴细胞的制备
无菌操作取出小鼠脾脏,研磨成单细胞悬液,用红细胞裂解液或者小鼠淋巴细胞分离液去除红细胞,将细胞过 40 μm 细胞滤网后,进行细胞计数。样本清洗液洗涤(可用 PBS 或者不含血清双抗的培养基代替),1 500 rpm 离心 5 min,用 PBS 重悬,调整细胞浓度为 107/ml。
2. CFSE 标记脾细胞
取部分细胞作为不染色组阴性对照,其他细胞加入 CFSE 溶液,使得终浓度为 5 μm,室温避光孵育 15 min,加入 5 倍体积的完全培养基,室温静置 5 min,释放多余的未结合的 CFSE 来终止其染色。1 500 rpm 离心 5 min,用与 CFSE 染色时相同体积的 RPMI 1640 完全培养基重悬细胞沉淀,使其细胞浓度仍为 107/ml。
3. ConA 与脾细胞孵育
取 96 孔圆底细胞培养板,CFSE 染色组和不染色组分别设置 ConA 组和 PBS 组,将细胞进行铺板,先将 CFSE 染色和不染色的细胞 2 倍稀释,每孔 100 μl 细胞铺板。
将 ConA 储存液进行 100 倍稀释,在 ConA 组中每孔加入 100 μl 配置好的 ConA 工作液,使得终浓度为 5 μg/ml(这时就是 200 倍稀释啦),在 PBS 组中加入 100 μl 完全培养基(这样铺板密度就为 5×105/ 孔)。将细胞培养板置于 37 ℃,5% CO2 的培养箱中培养 72 小时。
4. 流式上机检测
收集各组细胞,染色组细胞进行 CD3 表面染色,以对脾细胞中的淋巴细胞的增殖进行检测。流式 FITC 通道分析增殖的脾细胞所占的比例。
☟☟☟
— 看看我做的结果吧 —
用的 BD C6 流式细胞仪,直接截图啦。首先是不染色组,圈出 P1 门,直方图圈出细胞,基本都是 CFSE 阴性的。
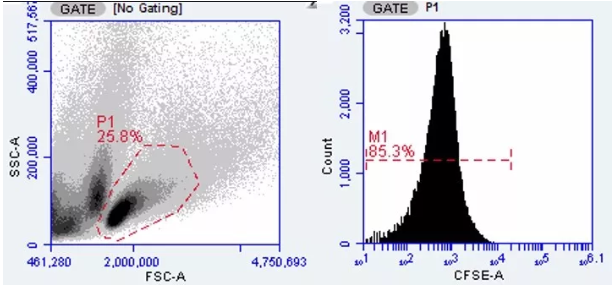
接下来看染色组,因我们分析的是脾淋巴细胞,所以是在 CD3 in P1 门里看 CFSE 阳性,发现几乎所有细胞都被 CFSE 染色。细胞增殖仅为 1%。
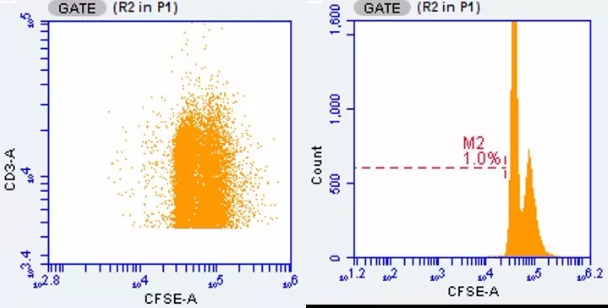
在 ConA 刺激组的直方图中,我们可以明显看到与 PBS 组相比,左边多出 3 个小峰,这就是增殖的脾淋巴细胞啦,同样在散点图中也能看到与 PBS 组相比多出三个分群,这就说明细胞在 72 h 里传了三代。

好啦,实验结束,是不是更方便简单明了呢?