Cell 子刊:郭尚勤团队报道荧光计时器,可实时监测活细胞周期速度
细胞的分裂与增殖是细胞生命活动的基本过程之一。无论是在发育过程中的细胞分化、再生、重编程,还是在许多疾病,包括癌症的发生过程中,细胞周期的快慢都有可能发生改变。 因此,测定细胞分裂周期的速度或长度,尤其是在组织甚至体内对细胞分裂的周期进行测定,能够帮助我们更好地理解发育过程和疾病的发生过程,在基础研究中有着重要的意义。然而现有的细胞周期测定技术有其局限性,在活体内实时监测细胞周期的动态变化仍存挑战。

2020 年 6 月 23 日,来自耶鲁大学的郭尚勤团队与合作者在 Cell Reports 上发表了题为 Resolving Cell Cycle Speed in One Snapshot with a Live-Cell Fluorescent Reporter 的研究成果。 该研究通过一种可以变色的荧光定时器(Fluorescent Timer,FT)作为报告蛋白,成功地完成了在活体内对不同细胞周期速度的测定与分选,填补了这一领域技术上的空白。

研究背景
现有的细胞周期检测方式存在一定的局限性:第一,大多数检测方法并非直接监测细胞的分裂,而是通过检测一个细胞群内处于不同细胞分裂期(G0/G1,S,G2,M)的细胞比例来间接推测细胞分裂的频率,当细胞分裂停滞在某一个时期时容易产生较大的误差。很多情况下因需要固定,活细胞检测难以实现。 第二,在显微镜下实时检测细胞分裂的频率固然准确,但很难在活体中实现实时的检测,也难以后续对不同分裂速度的细胞进行分离。 第三,标记保留技术(Label retention assay)能够监测细胞分裂和迁移的过程,在干细胞领域成果斐然。但因标记物终会消失,难以实现对细胞分裂周期的长期追踪,对于细胞周期差距较小的细胞也难以做出区分。 综上,在体内实时监测活细胞周期速度的方法目前还较少,相关技术的发展亟待解决。
研究内容
利用荧光定时器(FT)在体外测定细胞周期速度
细胞每次分裂时,胞内所有分子数量减半。对于半衰期明显短于细胞分裂周期的蛋白,考虑到其快速的代谢速率,这种减半引起的分子数量减少并不明显;而对于半衰期与细胞分裂周期相当或更长的蛋白,这种减半作用就能够在细胞分裂后明显地体现出来。 基于这一原则,细胞周期的长度可以通过测定两种半衰期迥异的分子在胞内的相对浓度来推定。荧光定时器(FT),就是一种可以「身兼两职」的蛋白分子,这种蛋白质在新合成时呈蓝色,而在一段时间(1.5h)后,它会转化成一种更稳定的,半衰期更长的红色形式。 其蓝色形式的半衰期远小于哺乳动物细胞周期,可以用于模拟短半衰期分子;而其红色形式的半衰期与通常细胞的细胞周期相近(约为 24h),可以用于模拟长半衰期分子。因此,在将 FT 蛋白导入细胞后,就能够通过测定细胞中蓝 / 红荧光的比值(BR 值)测定细胞周期的长度(即速度)。
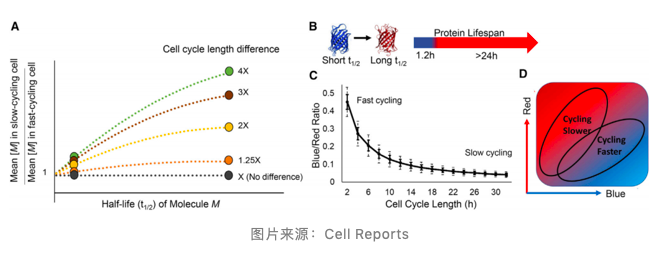
研究者首先通过数学模型的模拟和 Hela,MEF 等体外培养的细胞系验证了这一点,并说明了细胞周期越短(快),BR 值越高。作者随后将 FT 蛋白导入小鼠胚胎干细胞(mouse Embryonic Stem Cells,mESCs)并利用视磺酸(Retinoic acid,RA)诱导其分化,直接观察到了明显的因分化引起的细胞周期增长和细胞周期的异质性。BR 值变化与 DAPI 染色等传统方法有很强的吻合性,支持这一新方法在测定复杂体系中细胞周期动态变化和异质性的能力,展示了这一方法在研究干细胞的分化和命运决定(fate decision)过程中细胞周期变化的潜力。 利用荧光定时器(FT)测定活体细胞周期速度并进行细胞分选 为了测试这种方法能否在活体内应用,作者将 FT 蛋白导入了造血干细胞和祖细胞(hematopoietic stem and progenitor cells,HSPCs)中并将导入后的细胞移植进小鼠体内,并在后续通过流式细胞仪进行分析和分选。实验证明这种方法能够很好地测定和分选不同血细胞周期的速度,其测定结果符合预期(图 A-D)。

为了将这一方法利用在更多组织与细胞中,作者构建了可 Dox 诱导的 FT 小鼠模型(图 E),使 FT 蛋白可以在特定组织或细胞中可控表达。
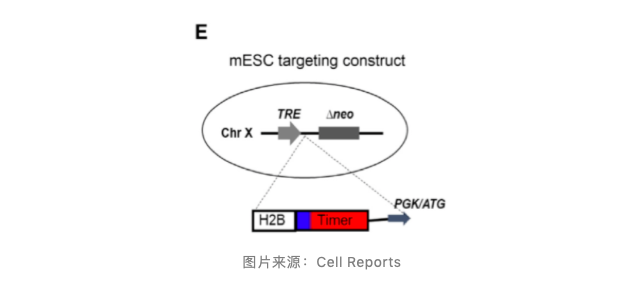
Rosa26:rtTA 使 FT 蛋白在绝大多数组织和细胞中经诱导表达,小鼠健康且可育。提取骨髓细胞进行分析,其分析结果也与移植造血干细胞的结果相符合(图 F-G),证明了这一方法在小鼠模型中的应用。

作者随后利用这种方法分析了正常小鼠和急性粒细胞白血病模型小鼠外周单核血细胞的细胞周期(图 H-I),证明了该方法在疾病模型中的应用。

经过仪器的校正后,BR 值可以提供细胞周期的具体长度。通过这一方法测出的小鼠红细胞前体的细胞周期长度是 4.3 小时,与其他方法检测到的结果相当一致。这一新方法的优异之处在于可以很方便地按细胞周期速度分选出活细胞,并且不再受限于细胞群内的异质性。 随后作者又继续在小鼠模型中通过对于肾脏,贲门和发育过程中的脑皮质的组织切片进行分析,发现这一方法能够很好地标记不同类型的细胞周期速度,并能够揭示不同组织中细胞周期速度的原位空间分布,对于了解组织的发育、稳态行成有重要意义。
文章总结

本文以变色荧光定时器 (FT) 蛋白为基础,利用其可以同时模拟两种不同半衰期分子的特点,成功地在体内和体外条件下完成了对于复杂体系中不同细胞周期速度的测定和分选,并衡量了这一方法在不同组织、细胞中的普适性,证明了该方法在研究不同组织,细胞的分化,发育过程中的广泛应用。
编者点评
在发育过程中,如何对不同分化的细胞进行分型、标记,一直是一个难以克服的问题。在本文中,作者别出心裁地利用一个可以随时间变色的荧光蛋白,完成了对于活细胞周期速度的荧光标记。 这一方法不仅可以在干细胞的发育工程中监测其分裂的速率,更可以利用不同的荧光标记对于快速分裂的活细胞进行分选,是研究干细胞发育的有力工具。 同时,这一方法也可以延伸到组织切片中,对于组织中不同种类的细胞根据其细胞分裂的速度进行标记,有助于我们理解组织中不同类型细胞的分布,并对于研究组织的发育,再生过程有着重大的意义。并且还可以定量的测定细胞周期长度,是帮助我们理解细胞的分裂,更新过程的重要工具。 作者在这一工作中构造的细胞系模型和小鼠模型也拥有很强的普适性,为今后在这一方面的研究提供了重要的工具(已投放于 Addgene 和 Jackson Lab)。










