合作专家 | 杨浩博硕士
细胞生物学 北京林业大学
审核专家 | 张望博士
感染病学 浙江大学
简介
在探索基因功能的实验中,我们需要过表达目的基因以判断其发挥的功能,因此我们需要将目的基因构建到表达载体上,再将载体通过侵染或瞬时表达的方式转入植物。双酶切实验可以将载体由环状变为线状,线状载体和带有同源臂的目的基因进行同源重组即可完成载体构建。
原理
核酸限制性内切酶是在原核生物中发现的一类专一识别双链 DNA 中特定碱基序列的核酸水解酶,他们的功能类似动物的免疫系统,用于抗击外来 DNA 的侵袭。现已发现几百种限制性内切酶,他们以内切方式水解核酸链中的磷酸二醋键,产生的 DNA 片段 5' 端为 P,3' 端为 OH,由于限制性内切酶能识别 DNA 特异序列并进行切割。
材料与仪器
步骤
1. 选择酶切位点。根据表达载体上多酶切位点的情况,选择合适的酶切位点,一般不选择位置相距很近的酶切位点以保证酶切效率。(红框内为多酶切位点区域)

2. 根据选择的酶切位点,选择合适的酶切反应缓冲液(一般会随限制性内切酶赠送)。
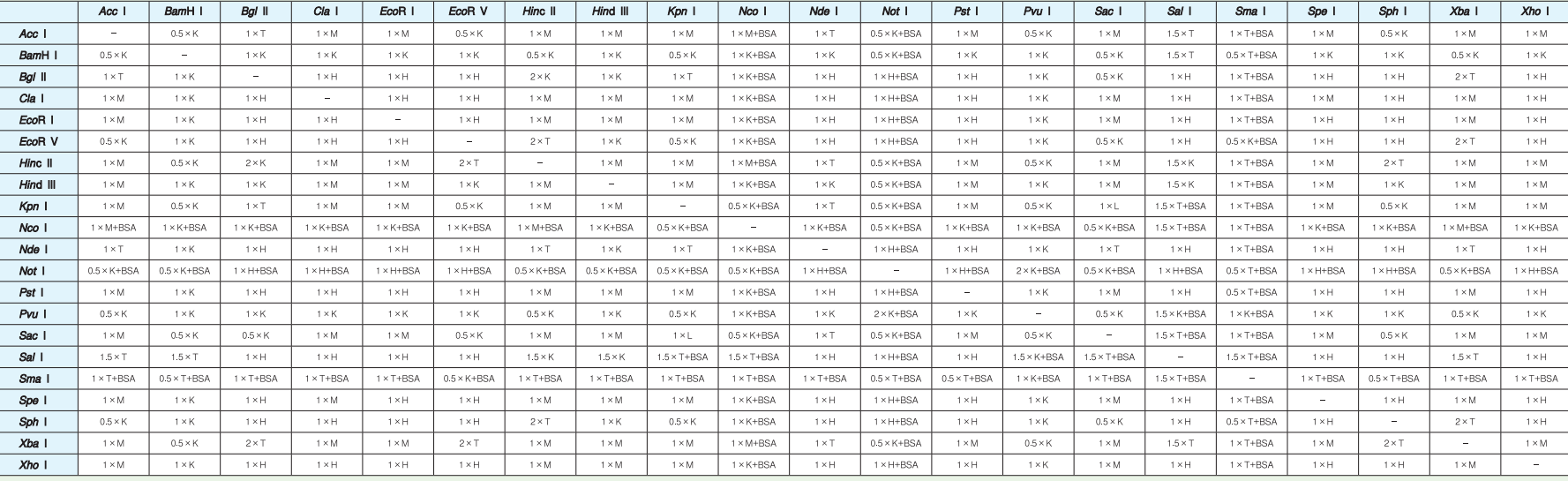
图示为某品牌限制性内切酶对应酶切反应缓冲液对照表,如选择 BamHⅠ和 Acc Ⅰ为酶切位点,则需要 0.5xK 缓冲液做为反应缓冲液。
3. 反应体系(总体系 50 μl): 酶Ⅰ 1.5 μl
酶Ⅱ 1.5 μl
Buffer(按照说明书即可)
载体 15 μl(不超过推荐的 DNA 最大用量)
补水至 50 μl
4. 37 ℃ 水浴(金属浴或 PCR 仪均可)4 h。
5. 水浴到时间后通过加入 loading buffer 或使用热灭活的的方式终止反应。
6. 琼脂糖凝胶电泳验证酶切结果(未酶切的载体作为对照)由于酶切后的载体为线性 DNA,未酶切的载体为环状 DNA,在电泳时线性 DNA 的迁移率更低,所以二者的电泳结果不会处于同一位置,以此来判断酶切结果。
7. 将酶切好的条带切下进行胶回收即可。
注意事项
1、步骤 1 中,选择酶切位点时一般要尽量避免目的基因中含有相同的酶切位点,然而并不是所有情况下都可以避免,因为有些目的基因几乎含有载体中所含的全部酶切位点,如果遇到此类基因,务必要保存表达载体空载,一旦载体构建完成,目的基因含有酶切位点的表达载体很难再次改造。
2、步骤 2 中,公司附赠的缓冲液可能是 10x 缓冲液,选用时需要看清浓度。
3、步骤 3 中,此反应体系为作者常用的反应体系,实际操作中,载体量应严格按照限制性内切酶的说明书中推荐用量的要求,不然可能会影响酶切效率,导致未线性化的载体偏多,影响后续同源重组的阳性率。
4、酶切好胶回收后的载体不易长期使用,回收后两周以内效率较高。
常见问题
1. 问:在后续实验中,同源重组总是连接不上怎么办?
答:步骤 6 中的电泳验证,只能说明载体已经成为线性载体,但是我们需要的双酶切均把载体切开,所以有可能是酶切效果不好导致。如果总是连接不上,并且经过同源重组试剂盒中对照载体及片段重组及转化,确认重组反应及转化环节正常时,建议重新酶切。
2. 问:总是切不开怎么办?
答:根据经验来说,可以把步骤 4 换一种加热方式,不同实验室情况不同,可能是选用的加热方式不稳定导致。或者考虑后续使用单酶切、反向 PCR 等方法重新线性化载体。
来源:丁香实验







