材料与仪器
步骤
腺病毒滴度检测采用TCID50法:
滴度单位:PFU/mL,是空斑形成单位,为Plaque Forming Unit per mL的缩写。
1、加病毒
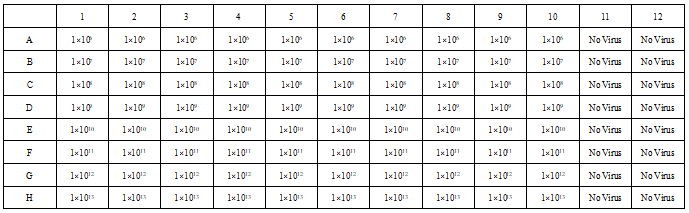
- 将 96 孔板中的 11、12 两列各加入 100 μL 5% FBS 的 DMEM,做阴性对照;
- 96 孔板中的 A-H 排,依次各加 100 μL 标记为 8 个连续梯度稀释的病毒样品溶液,盖上第一个板并在37°C CO 2 培养箱中培养;
- 同样步骤操作第二块板;
实验中培养板的结构如下图:
2、观察结果并计算滴度
- 将 96 孔板置于 37°C CO2 培养箱中培养 10 天,从第 3 天到第 10 天观察细胞状况。
- 第 10 天分析、记录 CPE 结果:
CPE 应在 10 天之内出现。第 10 天在显微镜下观察每孔 CPE 情况,并与阴性对照的一排对比,记录每排样品的阳性孔数。
注意:如有一个板被污染,实验必须重做
3. 病毒活性计算公式:
对于 100 μL 样品,滴度 T=101+d(s-0.5)
d=log10 稀释度=1(对于 10 倍的稀释度而言)
s=阳性比率之和(从第一个 10 倍稀释度算起)
将 TCID50/mL 转换成 PFU/mL:
T=a×10bTCID50/mL=a×10b-0.7PFU/mL
两次重复实验得到的滴度值应相差 ≤100.7
以 Ad-GFP 滴度测定为例: 测定结果为 1.99×1011PFU/mL
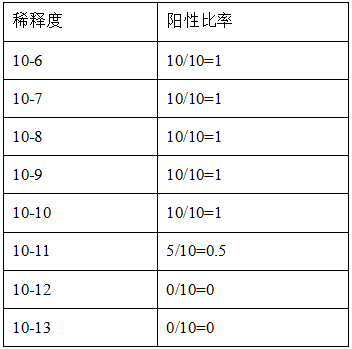
滴度: T=101+(10.5-0.5)=1011.0TCID50/100uL
将 TCID50/mL 换算成 PFU/mL
T=1011.0-0.7/100uL=1010.3/100uL=1.99×1010PFU/100uL =1.99×1011PFU/mL
注意事项
- 稀释病毒液时要充分混匀。 每次吸病毒液时要更换 Tip 头,以防导致稀释不准确。
- 本检测须做两组重复实验,两组实验可在同一天进行,也可在不同天进行。
常见问题
Q: protocol 中所说的 CPE 和 TCID50 具体是指什么?
A:CPE(cytopathic effect)指的是病毒感染细胞后导致细胞出现病变效应,TCID50(tissue culture infective dose 50%)指的是半数组织培养感染剂量,即50%的细胞发生 CPE 时的病毒稀释度。
Q:什么是 VP、PFU、IU?
A:不同的概念缘于不同的滴度测定方法,这些方法包括 2 类:物理方法(VP)和生物学方法(GTU、PFU、TCID50)。
VP:病毒颗粒(viral particle),是「活」(有感染性) 和「死」(无感染性)的腺病毒颗粒的总量。
PFU:空斑形成单位(plaque formation unit),是有感染性的「活」的腺病毒的总量,即腺病毒得活性单位。
IU:感染单位(infectious unit),和 PFU 一样,是另一种腺病毒活性单位。测定方法是 TCID50 法。
Q: TCID50 测定腺病毒滴度可以用 293t 细胞吗?
A:不可以,腺病毒确实 E1A 基因,该基因与病毒复制相关,293A 细胞是反向表达 E1A 基因的细胞系,腺病毒感染后可以复制扩增,293t 不能反向表达该基因,腺病毒感染后不能复制扩增。
来源:丁香实验