材料与仪器
器材:
① 一台荧光激活细胞分选仪及分析系统(可选)
② 真核荧光蛋白表达载体系统(例如,BD clontech 公司帕罗奥图,加州 Living Colors 载体)
③ 限制性内切酶和缓冲液,大肠杆菌宿主株(如 HB101),培养基(如 LB)和氨苄青霉素
④ 细胞:Jurkat,P19 胚胎瘤(EC)及 HEK293
⑤ 培养基:RPMI 1600 用于 Jurkat 细胞;DMEM 用于 P19 和 HEK293 细胞
⑥ 电穿孔仪器和样品槽(如 Bio-Rad 公司产品,海格立斯,加州)
⑦ 白炽灯光源(如光纤灯等)
⑧ 固定剂(如多聚甲醛)
试剂:
① 磷酸钙(CaPO4)转染试剂:250 mM CaCl2,2X HBS(280 mM NaCl,50 mM N-(2-羟乙荃)哌嗪-N-2-乙磺碱(HEPES),1.5 mM Na2H2PO4,pH7.1),无菌水;
② 标准细胞培养试剂和添加剂;
③ Geneticin(G418)(Invitrogen 公司,尤尔斯巴德,加州);
④ DNA 染料(如 Hoechst 33342)。
步骤
将荧光蛋白表达载体转染到细胞实验基本过程可分为以下几步:
A. 采用下述载体和方法建立稳定表达荧光蛋白的 Jurkat 和 P19 EC 细胞。将 pIV 质粒电转到 Jurkat 细胞(SC,Pruitt,未发表数据)。P19 EC 细胞则电转入 pIV 或基因捕获载体而构建基因捕获文库,如图 13-1B 所示。基因捕获载体的特点是从 5'到 3'端包含有一个剪切位点,一个三联的转录终止序列,后者可以终止转录内源性蛋白,另外还有一个内在的核糖体插入位点和一个报告基因(如 EGFP),一个多聚腺苷酸尾、一个来自(希文)-β-珠蛋白的绝缘子序列,一个 Pgk 启动子,以及新霉素抗性基因和供体剪切位点。
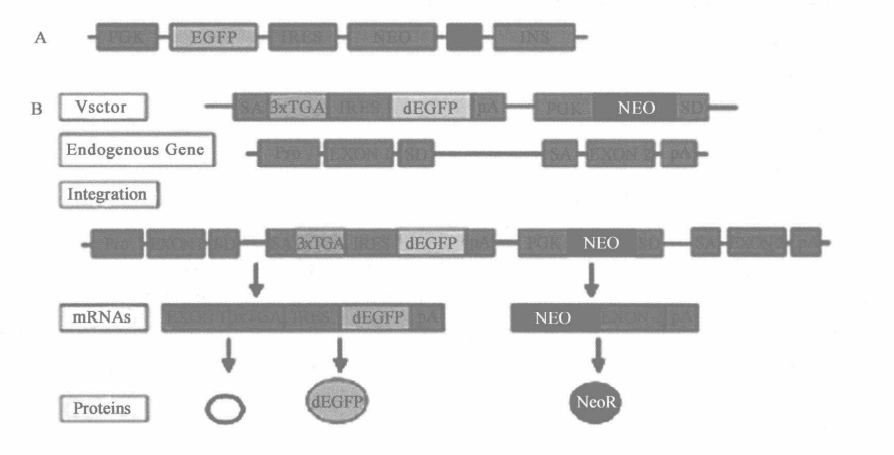
B. 电穿孔时载体被线性化,然后导入细胞。利用 Bio-Rad 公司的 Gene Pulser Ⅱ,参数为 200 V,500 μF。1 ml 中含有 1 × 107 细胞,大约 40~60 μg DNA。
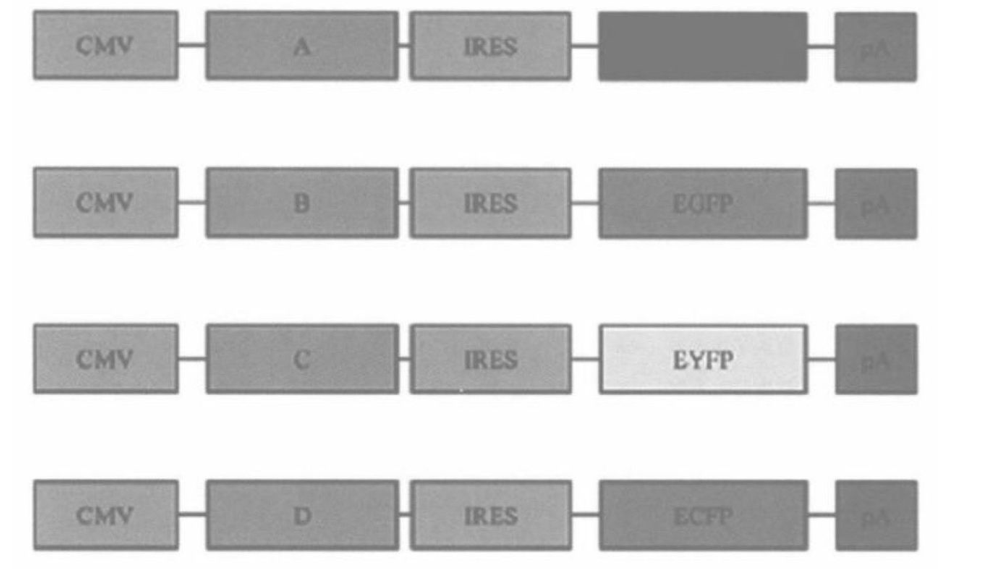
C. 细胞在 G418 存在情况下培养 10 d,存活细胞大约来自 1500 个克隆。细胞经胰酶消化,传代扩增,直到大约 5 × 107。这些细胞经过胰酶消化和滤过标准程序处理,为 FACS 分析做准备。(也可以采用瞬时转染方法获得表达 DsRed2,EGFP,EYFP,和 ECFP 荧光蛋白质粒, 的细胞这些荧光蛋白都是构建在一个在第二个 CDNA3'端带有双顺反子的平行质粒中(图 13-2)。这些重组构建载体利用磷酸钙法,被分别转染到 HEK293 细胞。2 d 后,细胞被经标准方法滤过处理,1.5% 甲醛固定后用于流式分析)
来源:丁香实验