简介
皂素方法标记表面分子+胞内分子案例见图 4-5A, 人外周血单个核细胞用不同细胞因子处理后,对细胞表面分子(CD16 和 CD19)和胞内分子(phospho-STAT6)同时进行标记,以显示淋巴细胞亚群信号的差 异。结果显示 IL4 和 IL-12 刺激后,CD19 阳性细胞 STAT-6 发生磷酸化。用 TNF-a 刺激则可 诱导部分 CD19 阳性细胞 STAT-6 轻度磷酸化,但用干扰素和 GM-CSF 不能诱导 STAT6 的磷 酸化。CD16 阳性细胞在以上刺激条件下,STAT-6 无明显磷酸化发生。
材料与仪器
步骤
皂素方法标记表面分子+胞内分子的基本过程可分为如下几步:
(一)细胞准备
A 细胞培养。按 1×106。细胞/制的细胞量接种于标准组织培养板(6 孔、12 孔和 24 孔)。细胞株常用血清饱和 12 h(时间可不同)。如 Jurkat 细胞尽管是 T 细胞研究的常用模型,但 PTEN 和 SHIP-1 基因缺失导致信号分子主要通过 AKT 和 PI3 激酶效应途径。这种突变使 Jurkat 细胞与初始 T 细胞相比,能在培养时发生细胞增殖,而后者只能在接受外源性刺激后才能增殖。通常, 细胞在高浓度非天然血清中(如牛血清)生长时需要高浓度的生长因子,以提供细胞不能从其天然环境中获得的刺激信号。这样, 它们适应了在非天然环境中生长。在这样的环境中,它们常需要高刺激信号。在这样的条件下,许多信号系统并不反映其基础状态,而背景的活化则变得很明显。在抗体初始滴定时,常用 1 X106 细胞。正确理解某个细胞数的抗体滴度是获得优选信号/噪声比的重要先决条件。其原因是,最佳的抗体浓度和在细胞内结合靶抗原的效力,是反映每个细胞内被结合靶磷酸表位数目、细胞数、非特异性结合阻断剂浓度和能发生背景结合的功能之一。一旦最适条件确定后,细胞数和抗体量也就相应地被确定。如对同样的样本进行多个不同的标记,就有必要对细胞数进行相应放大,以便样本在固定和穿孔后,能被分成几个检测管进行不同染色与处理。
B 加入合适浓度的细胞刺激。除了不刺激/刺激样本外,还要准备对照染色(如同型对照或间标时单独的二抗对照)。再 37℃,15 min。
(二)固定并穿孔
A 直接加入浓缩甲醛溶液于细胞培养物中,使其终浓度达 1%~2%(如用 16% 甲醛溶液,按每样本 l00μL/mL 加入)。漩涡振荡培养板,使细胞均一分布并固定,重新 37℃,15 min。
B 用移液管上下吹打,并使样本细胞完全被移至流式细胞分析管, 冰浴。因其他细胞有固定剂存在,活化细胞更易黏附到塑料上,移液管上下吹打取出大部分这类细胞。通过前后的细胞计数算出丢失的细胞数。通过显微镜观察确定细胞被完全转移,因为培养板中有的地方对于新手来说常会发生明显的细胞丢失。
C 细胞离心(500 g,4℃,5 min)。
D 当细胞以中速漩涡振荡混合时,加入 1 mL 冰冷甲醇到细胞管中,将细胞通透。必须按合理的速率加入甲醇(如 2〜3 s/mL)。插入冰中 15 min
E 用 2〜4 mlPBS 洗细胞 3 次,确保将甲醇移去。如甲醇仍然存在,用标记液洗涤常会导致 FCS 蛋白沉淀,要避免这种现象发生。
F 冰浴条件下,用 200μL 皂素通透液通透 15 min。离心压紧细胞(500 g,4℃ ,5 min)。
(三)染色
除标记液用皂素标记缓冲液外,细胞在抗体混合液中的标记如下所述。用皂素标记缓冲液来制备抗体混合液是非常重要的,因为皂素引起的膜穿孔是可逆的,如用标准标记缓冲液,抗体将不能进入胞内与相应抗原组分发生结合。
A 来源于同一刺激条件的刺激细胞需要重新分配以进行不同抗体标记。在标记液中重悬细胞,按每样本 25~100μL 等分细胞。用于抗体标记的细胞浓度应控制在(0.5-1)X106 细胞,并按每样本 25〜100μL 等分。如每标记样本中细胞越少,其在流式细胞仪上的上样时间就越长。因而调整细胞数是很重要的。
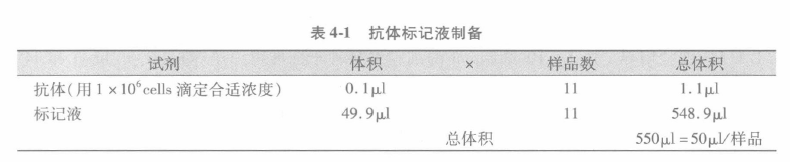
B 加入第一抗体至细胞液,孵育 30 min(有的试剂需要孵育更长时间,如 60 min)。通常我们制备一均质的抗体标记液用于所有的样本。这样,如抗体需要 0.1μL/样本,而我们有 10 个样本,我们就按 N + 1 的样本来制备 50μL 终体积。这样所有的样本都可以用同样体积的试剂来标记。
C 用 1 mL PBS 洗细胞两次后,用 l00 μL PBS-EDTA 重悬细胞。如果是第一抗体直接交联荧光基因,你可以马上在流式细胞仪上对样本进行分析。如果是间接标记(如用了第二抗体),继续 D。
D 按预先测定的稀释浓度加入荧光素标记的第二抗体(根据商品推荐浓度或以 1:500~1000 作为开始浓度),作用 15 min。如你要获得最低的非特异性背景标记,还应对样本做单独的二抗对照。还常检测二抗的滴度,以达到对信号的最大区分或鉴别。
E 用 PBS 洗细胞 2 次后,用 100 μL PBS-EDTA 重悬细胞,在流式细胞仪对样本进行分析。
F 调节流式细胞仪的电压,将同型对照或二抗对照控制在较低水平(如低于 101 log 荧光通道)。然后收获未处理样本,并将处理样本与未处理样本做相对比较。有时, 培养条件会人工活化信号系统(这样需要对大多数细胞株进行血清饱和处理)。如前所述, 这将增加未诱导细胞中一些激酶的水平。
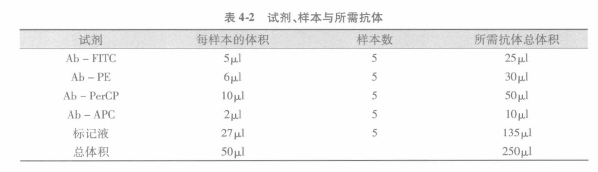
F 如上所述,用标记液制备抗体混合液。多颜色标记分析需要不同荧光素结合抗体来做补偿调节。在抗体混合液中,抗体混合液最终体积的 1/5 应该是标记液(含 4% FCS)。如要用较多稀释抗体,抗体混合液终体积可用标记液增加至 100μL。以下用四色标记进行举例。
G 一旦合适的抗体浓度确定后,无论是用于表面分子或胞内分子标记的抗体都可来制备抗体混合液。以下是抗体混合液制备方法举例。
总体积=50μL /1 x 106 细胞
如样本需要 X 体积抗体用量,就要制备 X + 1 体积的抗体用量。
因每样本的终体积是 50μL,所以要用标记液来调整。为确保在染色过程中有阻断试剂, 所需要标记液的最小体积是 10〜15μL。这样如果稀释抗体应用后,有必要时可将标记体积增至 100μL。
H 在 4℃ 冰浴条件下抗体标记 1 h(避光)。
I 用 PBS 洗细胞 3 次,用 100 μL PBS-EDTA 重悬细胞后,流式细胞仪分析。
(四)表面分子标记,胞内磷酸染色和其他胞内蛋白分子或流式参数(如细胞因子、Annexin V、非磷酸化蛋白)标记
随着能同时处理 15 个参数流式细胞仪的出现, 和对样本稀少并需要对表达多个表面标志的细胞亚群进行生化分析的需要,运用此种方法可提供常规生化方法不能分析的有关该细胞亚群的相关信息。对于那些来源有限的样本(如病人样本)而言, 能够获得尽量多的信息也是非常重要的。另外,结合磷酸化和其他参数,如胞内细胞因子产生和细胞状态(如细胞周期、凋亡)分析,单次实验就能提供有关细胞表型、信号转导和功能等相关信息。
来源:丁香实验


![PBST [10X]; Phosphate buffered saline with Tween-20; 80mM Na2HPO4, 1.5M NaCl, 20mM KH2PO4, 30mM KCl, 0.5% Tween-20, pH 7.4](https://img1.dxycdn.com/p/s14/2025/0321/123/2914240281077792091.jpg!wh200)




