简介
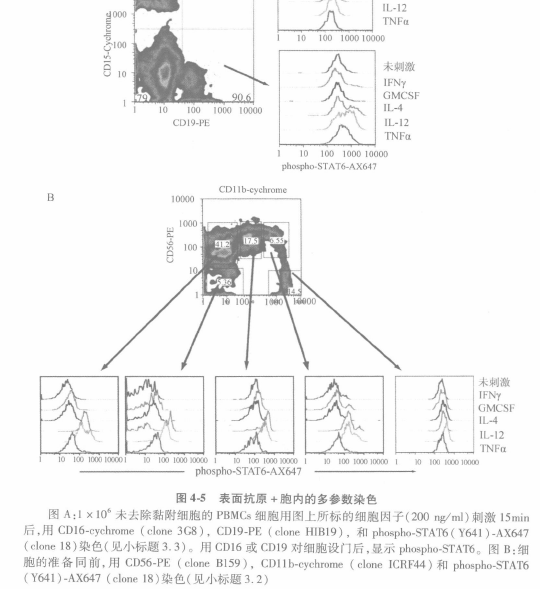
甲醇再水化法标记表面分子+胞内分子的相关案例显示在图 4.5B 中,图中人外周血单个核细胞(PBMCs)用不同细胞因子 处理后,同时进行表面分子(CD56 和 CDllb 抗体, 分别是 NK 细胞的标记和 MAC-1 的表达)和 胞内分子(phospho.STAT6)双标记; 然后,根据淋巴细胞亚群信号分子的差异进行设门。
材料与仪器
步骤
甲醇再水化法标记表面分子+胞内分子的基本过程可分为如下几步:
(一)细胞准备
A 细胞培养。按 1×106。细胞/制的细胞量接种于标准组织培养板(6 孔、12 孔和 24 孔)。细胞株常用血清饱和 12 h(时间可不同)。如 Jurkat 细胞尽管是 T 细胞研究的常用模型,但 PTEN 和 SHIP-1 基因缺失导致信号分子主要通过 AKT 和 PI3 激酶效应途径。这种突变使 Jurkat 细胞与初始 T 细胞相比,能在培养时发生细胞增殖,而后者只能在接受外源性刺激后才能增殖。通常, 细胞在高浓度非天然血清中(如牛血清)生长时需要高浓度的生长因子,以提供细胞不能从其天然环境中获得的刺激信号。这样, 它们适应了在非天然环境中生长。在这样的环境中,它们常需要高刺激信号。在这样的条件下,许多信号系统并不反映其基础状态,而背景的活化则变得很明显。在抗体初始滴定时,常用 1 X106 细胞。正确理解某个细胞数的抗体滴度是获得优选信号/噪声比的重要先决条件。其原因是,最佳的抗体浓度和在细胞内结合靶抗原的效力,是反映每个细胞内被结合靶磷酸表位数目、细胞数、非特异性结合阻断剂浓度和能发生背景结合的功能之一。一旦最适条件确定后,细胞数和抗体量也就相应地被确定。如对同样的样本进行多个不同的标记,就有必要对细胞数进行相应放大,以便样本在固定和穿孔后,能被分成几个检测管进行不同染色与处理。
B 加入合适浓度的细胞刺激。除了不刺激/刺激样本外,还要准备对照染色(如同型对照或间标时单独的二抗对照)。再 37℃,15 min。
(二)固定并穿孔
A 直接加入浓缩甲醛溶液于细胞培养物中,使其终浓度达 1%~2%(如用 16% 甲醛溶液,按每样本 l00μL/mL 加入)。漩涡振荡培养板,使细胞均一分布并固定,重新 37℃,15 min。
B 用移液管上下吹打,并使样本细胞完全被移至流式细胞分析管, 冰浴。因其他细胞有固定剂存在,活化细胞更易黏附到塑料上,移液管上下吹打取出大部分这类细胞。通过前后的细胞计数算出丢失的细胞数。通过显微镜观察确定细胞被完全转移,因为培养板中有的地方对于新手来说常会发生明显的细胞丢失。
C 细胞离心(500 g,4℃,5 min)。
D 当细胞以中速漩涡振荡混合时,加入 1 mL 冰冷甲醇到细胞管中,将细胞通透。必须按合理的速率加入甲醇(如 2〜3s/mL)。插入冰中 15 min
E 用 2〜4 mlPBS 洗细胞 3 次,确保将甲醇移去。如甲醇仍然存在,用标记液洗涤常会导致 FCS 蛋白沉淀,要避免这种现象发生。
F 用 500 似的标记液(含 4% FCS 的 PBS)重悬细胞 lh。充分洗涤和再水化可增加人细胞表面抗原表位的可检测性。让我们不能理解的是, 我们在小鼠表面抗原表位的检测中没有发现有何困难。
(三)染色
A 来源于同一刺激条件的刺激细胞需要重新分配以进行不同抗体标记。在标记液中重悬细胞,按每样本 25~100μL 等分细胞。用于抗体标记的细胞浓度应控制在(0.5-1)X106 细胞,并按每样本 25〜100μL 等分。如每标记样本中细胞越少,其在流式细胞仪上的上样时间就越长。因而调整细胞数是很重要的。
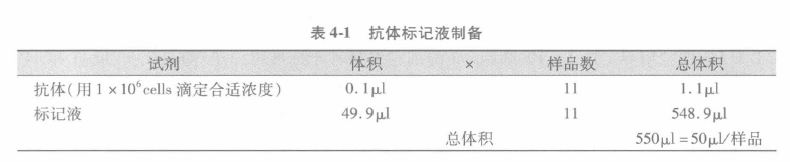
B 加入第一抗体至细胞液,孵育 30 min(有的试剂需要孵育更长时间,如 60 min)。通常我们制备一均质的抗体标记液用于所有的样本。这样,如抗体需要 0.1μL/样本,而我们有 10 个样本,我们就按 N + 1 的样本来制备 50μL 终体积。这样所有的样本都可以用同样体积的试剂来标记。
C 用 1 mL PBS 洗细胞两次后,用 l00 μL PBS-EDTA 重悬细胞。如果是第一抗体直接交联荧光基因,你可以马上在流式细胞仪上对样本进行分析。如果是间接标记(如用了第二抗体),继续 D。
D 按预先测定的稀释浓度加入荧光素标记的第二抗体(根据商品推荐浓度或以 1:500~1000 作为开始浓度),作用 15 min。如你要获得最低的非特异性背景标记,还应对样本做单独的二抗对照。还常检测二抗的滴度,以达到对信号的最大区分或鉴别。
E 用 PBS 洗细胞 2 次后,用 100 μL PBS-EDTA 重悬细胞,在流式细胞仪对样本进行分析。
F 调节流式细胞仪的电压,将同型对照或二抗对照控制在较低水平(如低于 101 log 荧光通道)。然后收获未处理样本,并将处理样本与未处理样本做相对比较。有时, 培养条件会人工活化信号系统(这样需要对大多数细胞株进行血清饱和处理)。如前所述, 这将增加未诱导细胞中一些激酶的水平。
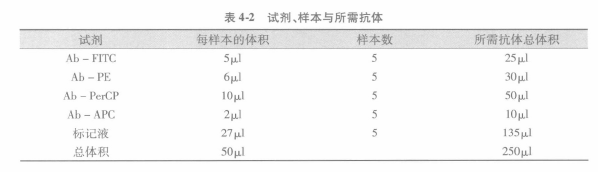
F 如上所述,用标记液制备抗体混合液。多颜色标记分析需要不同荧光素结合抗体来做补偿调节。在抗体混合液中,抗体混合液最终体积的 1/5 应该是标记液(含 4% FCS)。如要用较多稀释抗体,抗体混合液终体积可用标记液增加至 100μL。以下用四色标记进行举例。
G 一旦合适的抗体浓度确定后,无论是用于表面分子或胞内分子标记的抗体都可来制备抗体混合液。以下是抗体混合液制备方法举例。
总体积=50μL /1 x 106 细胞
如样本需要 X 体积抗体用量,就要制备 X + 1 体积的抗体用量。
因每样本的终体积是 50μL,所以要用标记液来调整。为确保在染色过程中有阻断试剂, 所需要标记液的最小体积是 10〜15μL。这样如果稀释抗体应用后,有必要时可将标记体积增至 100μL。
H 在 4℃ 冰浴条件下抗体标记 1 h(避光)。
I 用 PBS 洗细胞 3 次,用 100 μL PBS-EDTA 重悬细胞后,流式细胞仪分析。
(四)单步法细胞表面抗原分子标记区分荧光的亮/暗或抗原的中/高度表达
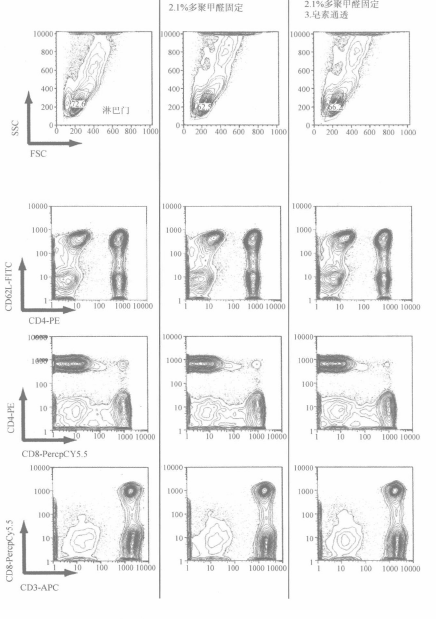
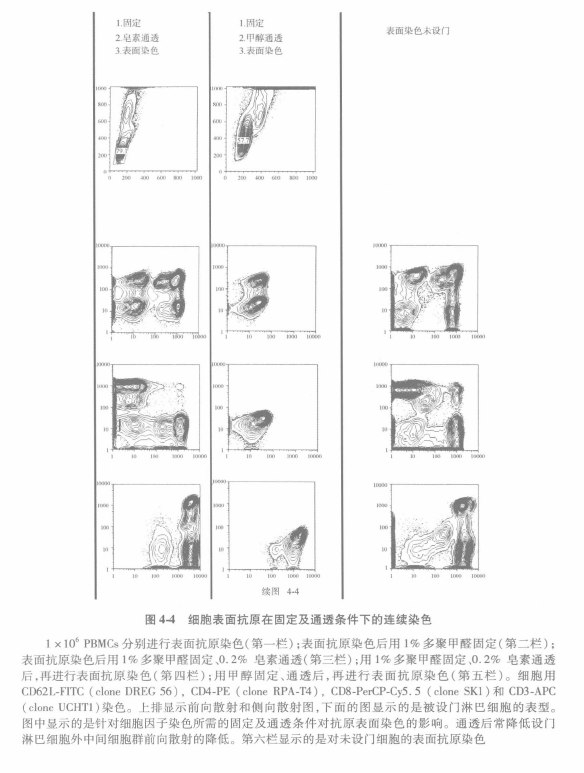
如在甲醇通透时所提及的,该方法的应用可能会引起某些表面抗原表位的丢失(如 CD8 细胞群)及不同表达水平差异的改变(如CDlla,CD45RA,CD62L);中水平和高水平表达可能会明显下降或严重交叉重叠。另外,在用甲醇或皂素通透后,一步标记法中侧向散射角(SSC)和前向散射角(FSC)特性常不能保持(图 4-4, 第四、五栏)。因为散射特性常用来区分人外周血中不同细胞群(如单核细胞和淋巴细胞),如其发生改变会导致分析上的困难。考虑到这些因素, 我们应用皂素通透相关技术来优化细胞亚群特性。
来源:丁香实验


![PBST [10X]; Phosphate buffered saline with Tween-20; 80mM Na2HPO4, 1.5M NaCl, 20mM KH2PO4, 30mM KCl, 0.5% Tween-20, pH 7.4](https://img1.dxycdn.com/p/s14/2025/0321/123/2914240281077792091.jpg!wh200)




