简介
哺乳动物细胞无疑是最理想的表达人类基因的系统。哺乳动物细胞表达系统的优势在于能够指导蛋白质的正确折叠,提供准确的O-和N-糖基化等多种翻译后加工功能,因而表达产物在分子结构、理化性质和生物学活性方面最接近于天然的高等生物蛋白质分子。
原理
一、常用的哺乳动物细胞表达载体
哺乳动物细胞表达载体主要有质粒载体和病毒载体两类。
(一)质粒载体
pcDNA3.1是目前应用最多的真核细胞质粒表达载体之一(图8-2)。
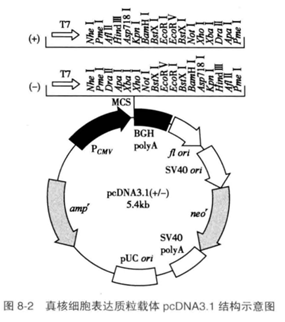
该质粒的主要结构包括:高效表达的CMV启动子,抗生素筛选标志amp'和neo',16个酶切位点的多克隆位点(MCS)和多腺苷酸化信号。在此载体基础上,又衍生出多种适合各种不同要求的载体,如pcDNA3.l/V5系列、pcDNA3.1/TOPO系列等。
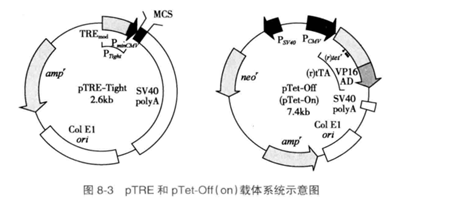
通常,基因表达前要在细胞培养基中保持高浓度的Tet或Dox使外源基因的表达处于封闭状态,然后通过逐渐降低Tet或Dox浓度的方式调控和诱导基因表达的水平。pTet-on与pTet-off的作用相反,所编码的rtTA调节蛋白(TetR序列中4个氨基酸改变)不能与TRE结合,因此不表达外源基因。当加入Dox后,被Dox修饰的rtTA才能与TRE结合,进而启动目的基因的表达(图8-3)。
其他常用的真核表达质粒载体还有pSI、pCMV、pBudCE4.1等。它们的不同之处在于转录元件筛选标记表位标签等不同。
(二)病毒载体
目前,多种病毒已被广泛地用于外源基因在哺乳动物细胞中表达的载体,这类载体在基因治疗中亦具有非常重要的价值。病毒载体的种类主要有反转录病毒(retrovirus)、腺病毒(adenovirus)、腺相关病毒(adeno-associated virus)、牛痘病毒(vaccinia virus)等。
1. 反转录病毒载体
2. 腺病毒载体
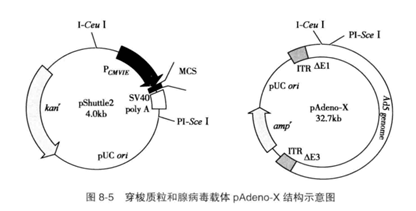
采用腺病毒载体进行表达时,需先将外源基因克隆到穿梭质粒中,在DH5α大肠埃希菌中扩增后,再经Pl-Sce I/I-Ceu I双酶切将基因表达盒与相应酶切线性化的pAdeno-X连接,构建重组腺病毒载体(图8-5)。
二、常用哺乳动物细胞表达的宿主
根据基因表达的目的与要求,可选择合适的细胞株,构建哺乳动物细胞表达系统。
1. 常用干稳定表达的细胞
来源于小鼠的L细胞、Ltk-细胞和NIH3T3细胞都是常用的研究基因功能的细胞系;小鼠骨髓瘤细胞株Sp2/0和NSO等来自于分泌型细胞,并且可以在无血清培养基中生长,因而适合用于高水平表达蛋白质。中国仓鼠卵巢(CHO)细胞已被广泛用于表达细胞因子、受体和单克隆抗体等多种不同类型的蛋白质。常用的人细胞株包括HEK293、HeLa、HL-60和HT-1080等。
2. 常用于瞬时表达的细胞
用途
目前,哺乳动物细胞表达系统已成为研究人类基因功能和生产基因工程药物与疫苗的主流技术平台。
材料与仪器
步骤
首先,选择合适的哺乳动物细胞表达载体,通过常规基因克隆操作插入外源DNA序列,验证插入序列的方向和正确性,扩增并纯化质粒;或将病毒载体转染入包装细胞株,获得有感染能力的病毒颗粒。
然后,将携带外源基因的质粒载体转染宿主细胞;或以病毒载体感染宿主细胞。阳性重组子可以选择性标记或表位标签进行筛选。应用电泳染色或免疫印迹法检测外源蛋白质的表达情况;应用不同的生物学方法分析蛋白质活性。
(一)流程一
实验流程8-6哺乳动物细胞外源DNA的电穿孔导入法
A. 转染前按照实验设计取出欲转染的DNA(1~20 µg)用于稳定转染(瞬时转染可以用到10~40 µg)。用乙醇沉淀法进行浓缩并灭菌,临转染前在洁净工作台内将DNA溶解在10 µl TE中。
B. 培养细胞至50% ~75% 汇合,4 °C、640 g离心5 min,收获细胞。若为贴壁细胞,可用胰蛋白酶消化并用血清将胰蛋白酶灭活。
C. 用原培养基1/2体积冰浴预冷的电穿孔缓冲液重悬细胞,4°C、640 g离心5 min,弃上清。
D. 用冰浴预冷的电穿孔液重悬细胞,1X107个细胞/ml用于稳定转染,8X107个细胞/ml用于瞬时转染。
E. 在每个电穿孔专用细胞小室(cuvette)中加入0.5 ml细胞悬液并置于冰上。
F. 加入欲转染的DNA,手指轻弹混匀,冰上放置5 min。
G. 将电穿孔杯置于电穿孔仪内,在优选的条件下电击一次或多次。电压、电容及电击次数因细胞不同而异,应进行优选。一般电压为250~750 V/cm,电容为25 µF,脉冲时间为20~100 ms。
H. 电穿孔杯置于冰上10 min。
I. 用20倍体积的完全培养基稀释转染细胞并淋洗电穿孔杯以收集所有转染细胞。
实验流程8-7脂质体DNA瞬时转染方法(贴壁细胞)
A. 将1X105~5X105细胞接种在6孔细胞培养板内,加入2 ml含10% 血清和双抗的DMEM培养基培养细胞。
B. 待细胞至70% ~90% 汇合(最好24 h内),于转染前1 h更换为无血清和无抗生素的培养基(800 µl)。
C. 在100 µ1无血清DMEM培养基(或Opti-MEM等其他无血清培养基)中加入重组DNA(1~5 µg),轻轻混匀。
D. 在100 µl无血清DMEM培养基中加入1~5 µl Lipofectamine™2000试剂,轻轻混匀,室温放置5 min。
E. 将步骤C和D稀释好的DNA和LipofectamineTM2000试剂混合均匀,室温放置20 min,以便形成DNA/Lipofectamine复合物。
F. 将200 µl DNA/Lipofectamine复合物加到细胞培养孔中,轻轻晃动敲打细胞培养板混匀。
G. 细胞在5% CO2、37 ℃培养箱中培养24~48 h后,收集细胞或培养基,进行转染后的基因和蛋白质检测。如果细胞株比较敏感,最好孵育4-6 h后,除去转染复合物,更换完全培养基继续培养。
(二)流程二
转染细胞的筛选
以G-418抗性筛选为例。细菌新霉素抗性基因(neo')是哺乳动物细胞表达载体最常用的选择性标记基因,编码氨基糖苷磷酸转移酶(APH),该酶可使氨基糖苷类抗生素G-418(新霉素衍生物)失活。
G-418能阻断细胞内的蛋白质合成,对原核和真核细胞均有毒性。如果将带有neo'的质粒导入细胞,并在含有G-418的培养基中培养(实验流程8-8),则未转染的细胞不能存活,从而可筛选出稳定转染有外源基因的细胞。
实验流程8-8转染细胞的G-418筛选法
A. 将待筛选的转染细胞(不超过48 h)制成细胞悬液,等量接种入多孔培养板中,培养6~12 h,吸除培养基,PBS洗涤1次。每孔加入含不同浓度G-418的筛选培养基(用培养基在100~1000 µg/ml范围内按浓度梯度配制)。
B. 换液:根据培养基的颜色和细胞生长情况,每3~5 d更换一次筛选培养基。
C. 确定最佳筛选浓度:在筛选10~14 d内能够杀死所有细胞的最小G-418浓度即为最佳筛选浓度。
D. 转染:转染后培养24 h或者更长,到细胞增长接近汇合时按1:4密度传代,继续培养,待细胞密度增至50~70% 汇合时加入G-418。
E. 加G-418:弃培养液,PBS洗涤一次,加入按最佳筛选浓度配制好的G-418筛选培养基。
F. 换液:同B。当有大量细胞死亡时,可以把G-418浓度减半维持筛选。筛选10~14 d后,可见有抗性的克隆出现,停药培养,待其逐渐增大。
G. 挑选单克隆:制备细胞悬液,细胞计数,用培养基稀释细胞到1个/10 µl。在96孔板中加入培养基150 µl/孔,再加入细胞悬液10 µl/孔,待其逐渐增大后转入到48孔中增殖。
来源:丁香实验








