简介
蛋白质-蛋白质相互作用在诸如生物催化、转运、信号传导、免疫、细胞调控等多种生命过程起着重要的作用,因此对这种作用的研究对于了解生命活动规律具有深远意义。GST pull-down 分析主要用于蛋白质-蛋白质相互作用研究。
原理
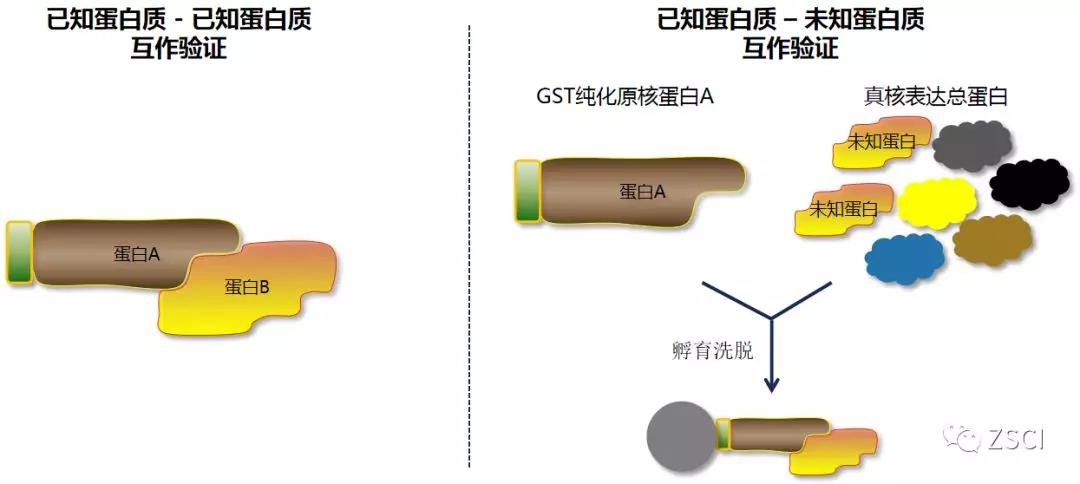
GST pull-down 技术原理是利用 GST 对谷胱甘肽偶联球珠的亲和性,从非相互作用蛋白质溶液中纯化相互作用蛋白质的方法。它通常有两种应用:确定 GST 融合钓饵蛋白与未知蛋白间新的相互作用,以及证实钓饵蛋白质与已知蛋白质之间可能的相互作用。前者需要用直接 SDS-PAGE(高丰度靶蛋白)或同位素标记后的 SDS-PAGE(低丰度靶蛋白)再偶联质谱等技术以确定靶蛋白的「身份」;后者则可用针对已知靶蛋白的抗体进行 Western 印迹检测。
用途
GST pull-down 分析主要用于蛋白质-蛋白质相互作用研究。
材料与仪器
步骤
(一)试剂配制
(1)裂解缓冲液 1% Triton X-100;150 mmol/L NaCl;2 mmol/L MgCl2;2 mmol/L CaCl2;10 mmol/L HEPES,pH 7.4。使用前加入蛋白酶抑制剂 [1 μg/ml 亮抑蛋白酶肽(亮抑酶肽)(Leupepin),1 μg/ml 抗蛋白酶(Antipain),1 μg/ml 苯甲基磺酰氟(Phenyl-methylsulphonylfluoride, PMSF), 1.25 μg/ml 抑胃肽酶(Pepstatin)]。
(2)PBS 缓冲液 NaCl,8.0 g;KC1,0.2 g;Na2HPO4 · 12H2O,2.9 g;KH2PO4,0.2 g;双蒸水定容至 1000 ml。高压消毒(通常在 1.034x105 Pa 下灭菌 30 min)。
(3)洗涤缓冲液 0.1% Triton X-100;10 mmol/L 巯基乙醇;PBS 配制。
(二)裂解细胞
(1)在培养瓶中培养细胞至 80% 汇合度。
(2)1000 r/min 离心 5 min 收集细胞,用 10 ml PBS 洗涤 2 次。
(3)细胞沉淀中加入 1 ml 裂解缓冲液,置冰上 20 min。
(4)4 ℃ 12000 g 离心 10 min,将上清液转移入新的 Eppendorf 管。
(三)GST 融合钓饵蛋白的结合
(2)4 ℃ 摇晃过夜。
(3)加入 80 μL 谷胱甘肽-琼脂糖球珠(50% 悬液),4 ℃ 混摇 4 h。
(4)4 ℃ 750 g 离心 5 min。
(5)用 1 ml 洗涤缓冲液洗涤球珠,4 ℃ 750 g 离心 5 min。重复洗涤 2 次。
(四)洗脱
(1)用 30 μL 2xSDS 样品缓冲液重悬沉淀的球珠。
(2)95 ℃ 加热 5 min。
(3)离心取上清液,该样随后用于 SDS-PAGE 以及 Western 印迹分析。
(五)SDS-PAGE 和 Western 印迹
(1)将胶浸于转移缓冲液中平衡 10 min。 注意:如检测小分子蛋白,可省略此步,因小分子蛋白容易扩散出胶。
(2)依据胶的大小剪取膜和滤纸 6 片, 放入转移缓冲液中平衡 10 min。 如用 PVDF 膜需用纯甲醇浸泡饱和 3-5 秒钟。
(3)装配转移三明治: 海绵 3 层滤纸胶膜 3 层滤纸海绵,每层放好后,用试管赶去气泡。切记:胶放于负极面 (黑色面)。
(4)将转移槽置于冰浴中,放入三明治 (黑色面对黑色面),加转移缓冲液, 插上电极,100 V,1 h(电流约为 0.3 A)。注意:应再次检查三明治和电极是否装配正确,电源是否接通。
(5)用 25 ml TBS 洗膜 5 min,室温,摇动。
(6)置膜于 25 ml 封闭缓冲液中 1 h, 室温,摇动。15 ml TBS/T 洗 3 次 (5 min/T)。
(7)加入合适稀释度的一抗,室温孵育 1-2 h 或 4 °C 过夜,缓慢摇动。15 ml TBS/T 洗 3 次 (5 min/T)。
(8)加入合适稀释度的碱性磷酸酶 (AP) 或辣根过氧化酶 (HRP) 标记的二 抗,室温孵育 1 h,缓慢摇动。15 ml TBS/T 洗 3 次 (5 min/T)。15 ml TBS 洗 1 次。
(9)蛋白检测 ( 显色法或发光法,按相应试剂说明操作) 。
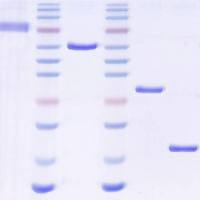
(六)实验结果及分析
以条带是否显现判断蛋白之间是否存在相互作用。
注意事项
(1)每一个蛋白质进行 GST pull-down 实验时都需要对条件进行优化。
② 与融合钓饵蛋白混合的靶蛋白的量 所需材料的量主要由靶蛋白的丰度和相互作用的亲和力决定,实验开始时这两个参数通常都是未知的,需要逐步摸索。
③ 清洗球珠的条件 含有不同盐及变性剂浓度的缓冲液被用来消除非特异性相互作用,因此其强度需要控制得当,否则会造成洗涤不充分或者破坏特异性结合的结果。
(2)注意设置对照,包括加入的总蛋白、非融合 GST 的 pull-down 样品等,如果实验失败,可以通过 Western 印迹分析总蛋白裂解液步骤 1.(4)、步骤 2.(4)收集的上清液、GST 对照的洗脱液、球珠和细胞裂解液对照的洗脱液以及洗脱后的球珠的成分来找问题所在。
(3)蛋白酶抑制剂 PMSF、巯基乙醇和丙烯酰胺等为剧毒物质,按规定操作。
来源:丁香实验