胶质瘤细胞系GL261细胞形态求助🆘
实验室搬砖员
前辈们好,我在养胶质瘤细胞系GL261细胞,不知道为什么,细胞在铺完板之后总是聚堆成团生长,如下图。细胞代次很新(p3),没有被刺激过。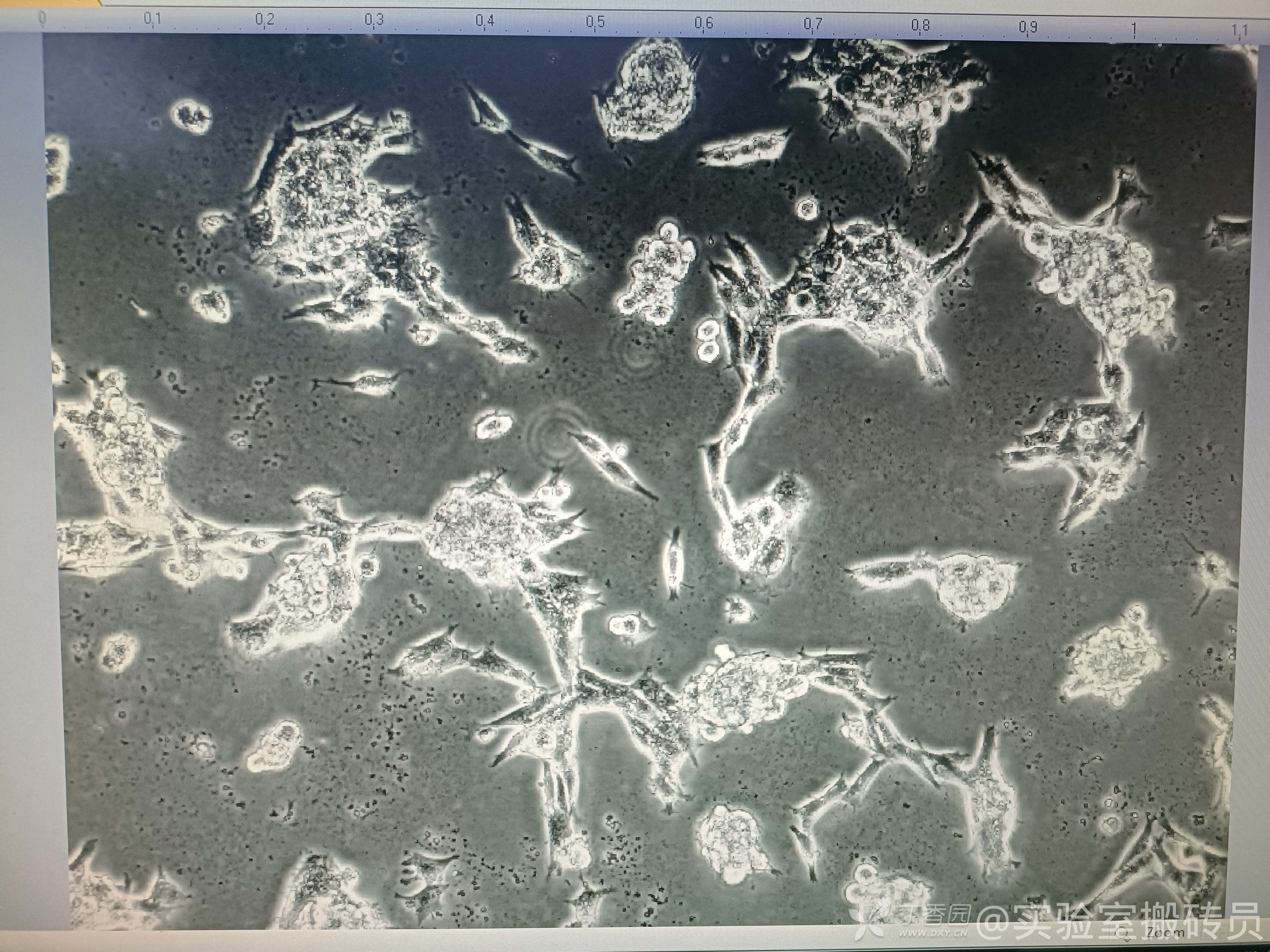
这个形态是正常的么?
恳求前辈们指导,谢谢大家~
4 个回答
z流沙z
这细胞基本不行了,可能是消化多度或者吹打太多,非常多的细胞碎片。可以再尝试一下,控制消化时间,拍拍培养皿侧壁细胞脱落即可终止消化,然后加培养基略微吹打后离心重新铺板,数小时后观察细胞贴壁了,可以用pbs再轻轻润洗两遍,去掉细胞碎片。
loveliufudan
可能是细胞贴壁不良导致细胞聚集成团生长。以下是一些可能的解决方案:
细胞密度调整:调整细胞的密度,通常使用的细胞密度为1×10^4到1×10^5个细胞/mL,过低或过高的细胞密度都会导致细胞不易附着在培养基上。
培养基选择:对于胶质瘤细胞系GL261,建议使用适当的培养基,例如DMEM/F12或DMEM高糖培养基,并添加10%的胎牛血清或FBS。
细胞处理前处理培养板:在细胞处理前,用70%乙醇对培养板进行消毒处理,并在空气流量下放置15-30分钟使其完全干燥,这样有利于细胞附着。
确保培养条件:细胞的生长需要适宜的温度、CO2浓度和湿度等条件,确保这些条件符合要求。
细胞冻存和解冻:确保在细胞冻存和解冻过程中正确操作,否则可能影响细胞的质量和附着性。
避免过度培养:胶质瘤细胞系GL261的生长速度较快,过度培养会导致细胞的代际老化和附着性下降。
sswei
原因:1. 细胞死亡释放出DNA,缠绕其他细胞,形成黏性的细胞团(消化的过程可能过于粗暴,吹打太用力,消化太久,消化液太强或有毒性等)。
2. 细胞离心速度过大或时间太长。
3. 消化不完全的时候,细胞和细胞之间的连接没有分开;消化过度的时候,圆形的细胞容易聚堆,再分开很困难!
4. 状态不好、老化的细胞,也可能会出现抱团生长的情况(比如换液不及时、长的太满才传代、污染等造成的细胞状态差)。
5. 传代时没有吹打均匀,细胞团多,培养时就会是一团一团的。
6. 传代后细胞铺板不均匀。
7. 有可能是杂细胞,或者死细胞。
8. 细胞未消化开。
9. 非震荡培养或细胞量过多的话就会成团。
如何避免细胞抱团?
1. 用无钙镁平衡盐溶液洗涤细胞。
2. 对于贴壁非常牢固的细胞,为了细胞更好的状态,更漂亮的样子,建议分多批多次消化,这样才能最大限度地降低胰酶对细胞的损伤,保证细胞的状态能够最优。
3. 细胞生长密度不要太高,70%-80%就好(细胞刚刚基本成单层细胞,没有出现堆叠生长),这样细胞抱团的的几率就大大减少了。如果细胞已经长成集落,可先将细胞低密度传代,第二天再消化传代,这样连续传三次,细胞抱团就会越来越小,这样几代过后,再按照常规消化方法和时间能将细胞逐渐传成单个的。
4. 消化过程中最好不要使劲摇动培养瓶,这样细胞特别容易成屑样脱落。细胞一旦脱落入悬液里就很难再将他吹打成单个(因为细胞没有受力点了,所以细胞很难分散开)。所以必须要在细胞未脱落之前将其吹打开,严格控制好消化程度。
5. 消化过程需要使用枪头轻轻吹打,切忌使劲拍培养瓶的侧壁。拍瓶子想要将细胞拍散的力度对于细胞来说相当于大地震,细胞本身是无法承受如此振荡的。
细胞抱团要如何处理?
1. 如果细胞抱团不影响生长就没问题,只是计数的时候要麻烦点了。
2. 如果感觉有死细胞的DNA,在细胞悬液中加入几滴无菌的DNAse(1mg/ml溶于水)将DNA链打断。轻柔地吹打细胞,防止对细胞膜造成物理损伤。
3. 如果细胞抱团是肉眼可见的,那就让细胞静置半半分钟左右,然后吸取上半部分没有抱团的细胞悬液来传代。如果细胞抱团肉眼不可见,那可能没有特别好的分离方法,只能等细胞状态改善后将这部分细胞慢慢排除出去。
毛利小五郎的徒弟
可以再观察看看,时间长了会打开的。