4 个回答
土井挞克树
如果核定位不好,建议封闭和打孔合为一步,即在封闭液中添加0.5% TRITON-100,37度封闭2小时,加一抗后最好4度孵育过夜(16小时)。
huarenqiang5
实验步骤
1. 在22x22 mm 的1.5号盖玻片上培养细胞。理想条件下细胞应长到50%~70%汇合。
2. 在-20℃用100%甲醇固定细胞3分钟。
3. 用PBS + 1% NGS洗三次,每次10分钟。
4. 在湿盒里以适当浓度的一抗室温温育1小时。
5. 用PBS + 1% NGS洗三次,每次10分钟。
6. 在湿盒里与稀释为4 ug/ml 的荧光标记二抗室温温育1小时。
7. 用PBS洗四次,每次10分钟。
8. 用封片剂将盖玻片封在载波片上,用干净的指甲油将盖玻片封边,防止盖玻片滑动。
注意事项
1. 要在盖玻片一边角落做记号,以知道细胞在盖玻片的那一面。
2. 一抗的浓度需要经过实验摸索确定。
3. 第四步中如果用22×22 mm 盖玻片,则在盖玻片上加30 ul 稀释的抗体,并且将盖玻片倒置在玻璃载玻片上,然后将载玻片放到湿盒里,在室温温育。
sswei
1、冰冻切片制备:建议用新鲜组织,否则组织细胞内部结构破坏,易使抗原弥散。选用干净锋利的刀片、组织一定要冷冻适度等,防止裂片和脱片严重。
2、组织切片固定:切好片风干后立即用冰丙酮等固定液进行固定 5-10 min,尤其要较长时间保存的白片,一定要及时固定和适当保存。
3、血清封闭:为防止内源性非特异性蛋白抗原的结合,需要在一抗孵育前先用血清(与二抗来源一致)封闭,减弱背景着色。血清封闭的时间是可以调整的,一般 10-30 min。
4、一抗孵育条件:在免疫组化反应中最重要,包括孵育时间和抗体浓度。一抗孵育温度有几种:4℃ 、室温、37℃ ,其中 4℃ 效果最佳;孵育时间:这与温度、抗体浓度有关,一般 37℃ 1-2 h,而 4℃ 过宿和从冰箱拿出后 37℃ 复温 45 min。具体条件还要摸索。
5、二抗孵育条件:二抗一般室温或 37℃ 立即观察,若将标本放在聚乙烯塑料袋中 4℃ 30 min-1h,具体时间需要摸索,而浓度一般有工作液,若是浓缩液还要摸索浓度,切记要避光反应。但在免疫荧光中一般先把二抗浓度和孵育时间先定下,然后去摸索一抗浓度和孵育时间。最后,荧光素标记的二抗随着保存时间的延长,可能后有大量的游离荧光素残留,需要注意配制时小包装和并进行适当的离心。
6、复染:目的是形成细胞轮廓,从而更好地对目标蛋白进行定位。一般常用 DAPI 复染。
7、封片:为了长期保存,一般用缓冲甘油等封片,此外还有专门的抗荧光萃灭封片液。避免产生气泡,方法是直接在载玻片组织上滴一滴封片液,然后一手拿住盖片某一拐角,而另一手拿对面的那个拐角,接近封片液近端的拐角先降低,直至接触到液体时为止;当发现液体接触面在不断弥散时,则可以缓慢降低另一拐角,这样一般不会产生气泡。
8、切片清洗:为了防止一抗、二抗等试剂残留而引起非特异性染色,所以适当地加强清洗(延长时间和增多次数)尤为重要,一般在一抗孵育前的清洗是 3 miundefined3 次,而一抗孵育后的清洗均为 5 次5_min。注意:单独冲洗,防止交叉反应造成污染。温柔冲洗,防止切片的脱落。用浸洗方式;冲洗的时间要足够,才能彻底洗去结合的物质。PBS 的 pH 和离子强度的使用和要求。建议 pH 在 7.4-7.6 浓度是 0.01 M。(中性及弱碱性条件(pH7-8)有利于免疫复合物的形成,而酸性条件则有利于分解;低离子强度有利于免疫复合物的形成,而高离子强度则有利于分解)
loveliufudan
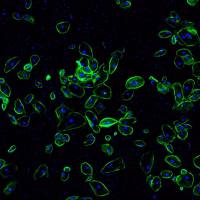
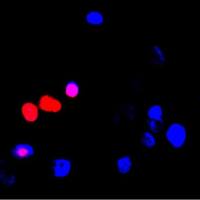
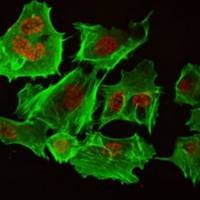
核蛋白免疫荧光是一种常用的细胞学和分子生物学实验技术,用于检测核内蛋白质的表达和定位。下面是一些注意事项和技巧,可帮助您在实验中获得更好的结果:
细胞固定:使用适当的细胞固定剂和条件固定细胞,以确保蛋白质的保留和细胞形态的完整性。常用的细胞固定剂有4% paraformaldehyde (PFA) 和methanol。
渗透化:细胞膜是有机膜,通常会对一些分子和化合物进行阻挡。为了使抗体能够渗透到细胞内并与目标蛋白质结合,必须进行细胞渗透化。 常用的渗透剂包括0.1-0.5%的Triton X-100和0.2-0.5%的Tween 20。
抗体:确保使用高质量、特异性良好的抗体,而且应按照建议的稀释倍数进行稀释,过高或过低的稀释倍数可能导致免疫荧光染色效果不理想。建议进行对照实验,例如使用无定位的抗体或者在细胞中过度表达目标蛋白等。
染色:为了避免非特异性的荧光背景,应在样本中加入适当的负对照和阳性对照。另外,染色时间也应该控制在适当的范围内,过短的时间可能导致染色弱,过长的时间可能导致背景过多。
显微镜观察:免疫荧光染色后,应使用合适的显微镜观察。常用的显微镜包括荧光显微镜和共聚焦显微镜。同时,也需要控制成像参数,如曝光时间和灵敏度,以获得最佳的成像效果。
相关问答