抗体非还原胶显示多种状态,怎么判断活性占比,如何更好分离?
丁香实验
重组抗体rProtein A提取后,跑非还原胶,有很多条带,有没有朋友帮忙解答我的困惑:
1.不同条带区别是什么呢?2.怎么知道那个组分是我要的正确结构呢?3.抗体精纯效果不是很好,不能把这些条带区分开(下面各泳道都是我不同的精纯条件),所以难以分别判断活性,请问有没有好的纯化方法推荐呢?
非还原SDS-PAGE 12%凝胶: 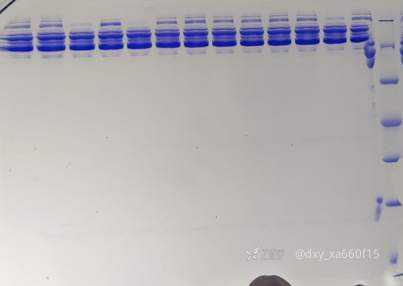 12%还原胶:
12%还原胶:

分享
5 个回答
西柚味的芋圆
有帮助
我感觉是样本降解了,或者说在某种状态下蛋白激活,产生了几个片段
txs900416
有帮助
如果纯化效果不佳,可以考虑一下protein G,培养基或者血清中有大量蛋白,prote inA/G的柱子会结合很多非特异性的蛋白
dxy_0mxazdaw
有帮助
有可能是样本降解了,或者样本中有污染,建议制备好样品后,尽早点样;还有一个原因,有可能上样缓冲液时间太久了,有效成分失效了,建议妥善保存各种试剂,避免反复冻融。对于重要的样本,建议用新的上样缓冲液,这个时候就别怕浪费了!
Timy最爱柠檬水
有帮助
可能是因为该蛋白是一个多聚体,存在多种结构,或者是蛋白提纯过程中受到了污染。
peaceful13
有帮助
不同条带的区别主要是分子量大小的不同~想要的组分需要了解你的目标抗体的分子量大小通过marker的条带去确定该分子量位置,如果纯化效果不佳~可以考虑一下protein G
相关产品推荐
提问
扫一扫
实验小助手
扫码领资料
反馈
TOP
打开小程序