求助 | 质粒保存在-20℃和-80℃会断裂或者消失吗?
派大星吃吃吃
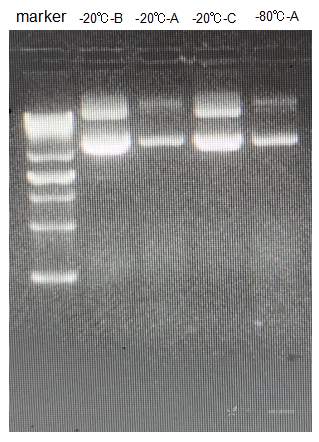
半年前菌液大提完的一管质粒A分装成两管分别冻存在-20和-80℃,其中-20℃的那管我经常拿出来使用,所以反复冻融比较频繁,最近发现质粒转染的效果不如以前了,我重新送测序和测浓度,发现测序没问题,浓度也没有降低。我就分别从-20和-80都吸出1ug质粒A跑核酸电泳,也拿了同期(半年前)一起大提的其他两种质粒B和C也吸取了1ug做阳性对照(其他两种也冻-20℃,转染效果一直很好),发现不管是反复冻融的-20℃的A还是一直保存在-80℃的A,A条带都比反复冻融的B和C要浅很多,但A B C我都是稀释成1ug/10ul 跑的,请问为什么啊?难道就A质粒容易断裂或者消失吗?
4 个回答
huarenqiang5
质粒保存在这两种温度时一般不会出现断裂及消失。
sswei
反复冻融质粒容易降解。尤其是室温较高时,双链DNA也会不稳定。建议分成小管使用,剩余部分冷冻起来,随用随取。
loveliufudan
以下是一些可能导致质粒A转染效果不如以前的原因:
反复冻融:您提到-20°C的A管经常被反复冻融,这可能会导致质粒A的完整性和稳定性受到损害。尤其是如果使用过程中加热时间过长或者温度过高,可能会导致质粒A的损伤更加严重,从而降低转染效果。
长期保存:即使质粒A存放在-80°C的低温环境下,长时间的保存时间也可能会对质粒A的完整性和稳定性造成影响。因此,即使A质粒是保存在-80°C的,也建议尽量缩短存放时间,避免长时间存储。
质粒稳定性:不同的质粒可能具有不同的稳定性,一些质粒可能更容易受到反复冻融、存储时间和其他环境因素的影响,从而导致质粒完整性和稳定性受损。因此,不同质粒之间转染效果的差异可能与质粒自身的特性有关。
质粒纯度:质粒纯度也可能会影响质粒的转染效果。如果质粒A的纯度较低,可能会存在其他杂质分子,影响质粒的稳定性和完整性,从而导致转染效果下降。
土井挞克树
短期内负二十不会,负八十半年内没问题
相关产品推荐
相关问答