免疫组化常见十大问题与解析
诺唯赞
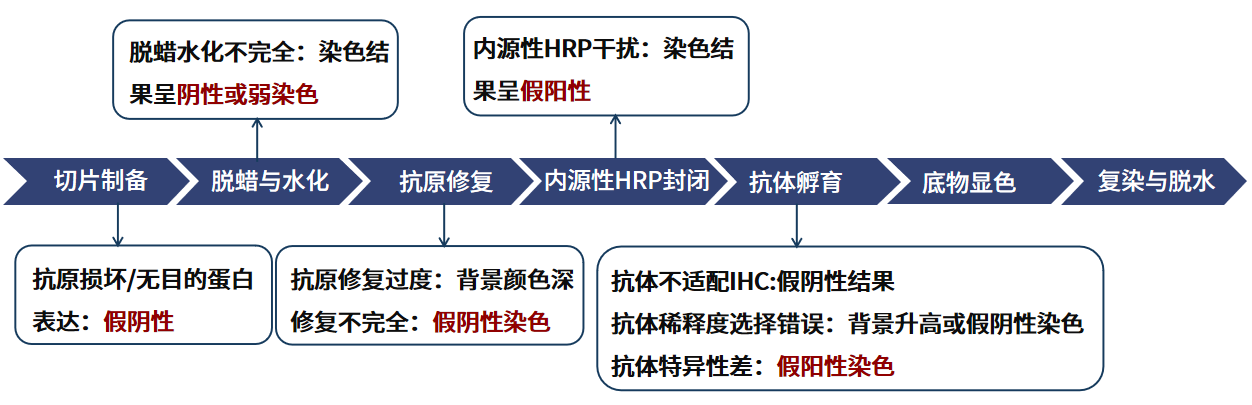
图 1 实验流程与常见问题索引
Q1:染色结果呈阴性,是怎么回事?
(1)抗体来源选择错误:本试剂盒二抗为抗兔/鼠,请确保一抗来源的种属为兔源或鼠源。
(2)组织切片本身不存在目的蛋白:可通过 The Human Protein Atlas 数据库或 UniProt数据库查询目的蛋白在细胞或组织中的表达情况。
(3)抗体浓度和质量问题:提高抗体工作浓度或延长孵育时间;确认抗体可进行IHC实验,通过非IHC实验排除抗体质量问题。
(4)脱蜡不完全:可根据切片上是否存在透明颗粒,判断是否存在脱蜡不完全,若存在,需延长脱蜡时间或换用新的二甲苯。
(5)抗原修复不完全:对于甲醛固定的组织必须用充分抗原修复来打开抗原表位,以利于与抗体结合。
(6)细胞通透不全,抗体未能充分进入胞内参与反应:可加入组织透化步骤,进行细胞膜或核膜的透化。
(7)试剂盒保存不当:请于 4℃ 进行保存,勿室温防止过长时间。
(8)封闭时间过长:若使用封闭液进行封闭,请排除封闭液对抗原抗体结合的影响。
Q2:免疫组化染色弱怎么办?
(1)抗体浓度过低,孵育时间过短:可提高抗体浓度,进行抗体4℃过夜孵育。
(2)组织或细胞中目的抗原表达水平低:可延长DAB显色时间或延长二抗孵育时间。
(3)试剂超过有效使用期:及时更换试剂。
(4)操作中,滴加试剂时缓冲液未沥干,致使试剂稀释:可每步滴加试剂前沥干切片中多余的缓冲液(但防止切片干燥)。
(5) 蛋白封闭过度:封闭时间不要超过 2h。
Q3:为什么出现高背景染色,怎么办?
(1)一抗浓度过高:对抗体进行滴定以确定获得特异性反应的最佳浓度。
(2)显色过度:缩短显色试剂 DAB 孵育时间。
(3)洗涤不充分:适当增加抗体孵育后的浸洗次数和延长浸洗时间。
(4)封闭不完全:使用正常山羊血清或 1%~5% BSA 封闭 1h。
(5)离子相互作用造成的背景:降低抗体稀释液的离子强度。
(6)切片或细胞过于干燥或孵育温度过高:实验过程中请保持切片处于湿润状态,一抗孵育时尽量使用 4℃ 过夜孵育。
(7)内源性过氧化物酶残余:适度延长内源性过氧化物酶阻断剂阻断时间。
(8)样本于缓冲液或抗原修复液中浸泡太久:样本在溶液中浸泡时间不要超过 24h。
Q4:为什么会出现非特异性染色,如何避免?
(1)抗体孵育时间过长、抗体浓度高易增加非特异性染色:由于本试剂盒使用 Polymer二抗进行了反应的放大,该方法敏感性较高,可缩短抗体孵育时间或降低抗体浓度。
(2)内源性过氧化物酶残余:适度延长内源性过氧化物酶阻断剂阻断时间。
(3)一抗导致的非特异性染色:多克隆抗体易于产生非特异性染色,结合抗体官网信息合理选择多克隆抗体或单克隆抗体。
(4)一抗种属来源与组织样本来源相同:如使用鼠源一抗检测小鼠组织,尽量选择种属来源与样本种属不同的一抗。
(5)切片或细胞过于干燥:实验过程中,需保持样本的湿润。
Q5:阳性染色细胞定位不正确,如何修正?
(1)抗原修复条件不合理:尝试改变抗原修复条件。
(2)固定方法不合理:可能由于不合理或不及时的固定导致抗原破坏,出现抗原弥散的现象,可尝试不同的固定剂或增加固定时间。
(3)离子相互作用影响抗原识别:尝试调整抗体稀释液的 pH 值或阳离子浓度。
Q6:切片边缘着色,怎么调整?
(1)样本边缘粘贴不牢,边缘松脱漂浮在液体中:增加清洗次数或延长清洗时间。
(2)试剂未完全覆盖样本:边缘的试剂容易首先变干,浓度较中心高而致染色深。免疫组化笔画圈应距组织边缘大于 3~4 mm,试剂要充分覆盖组织,应超出组织边缘 2 mm。
Q7:阴阳脸着色,到底是为什么?
即组织一半着色一般不着色:一般见于试剂分布不均匀或由于气泡导致的着色不均匀。试剂滴加后,应检查试剂是否分布均匀,可使用枪头将试剂引流开使之将组织全部覆盖。若滴加时易产生气泡,则滴加试剂时手法要轻,有气泡时用枪头捅破。
Q8:总是脱片,如何优化?
(1)烤片时间不够,或温度不够:可以延长烤片时间和提高烤片温度。
(2)用含有多聚赖氨酸的玻片。
(3)组织差异:有些组织本身就容易掉片,如骨组织等,进行清洗操作时洗涤液不要直接冲洗组织。
(4)使用高温修复时,温度骤冷:进行高温抗原修复时,需等待液体缓慢恢复至室温。
(5)冰冻切片未进行复温:冰冻切片应先于室温放置到复温后再浸泡至PBS中。
Q9:染色强度不均匀怎么办?
(1)切片厚度不均匀:切片的厚薄不一,可能导致染色呈现一边强,一边弱的情况。
(2)DAB 染色液未混匀:DAB 在样本上的浓度不一致,导致染色不均匀,加完显色液后最好将片子来回左右晃动几下,使片子上所有区域的底物浓度一致。
(3)试剂未完全覆盖样本:边缘易由于未覆盖而导致无染色或弱染色。免疫组化笔画圈应距组织边缘大于 3~4 mm,试剂要充分覆盖组织,应超出组织边缘 2 mm。
Q10:灶片状着色,如何调整?
(1)洗涤液的残留:洗涤液的残留可能导致其对后续试剂产生稀释作用,需尽量甩干样本残余洗涤液。
(2)坏死组织灶,组织坏死后细胞破坏、酶的释放、蛋白游离、分解,复杂的肽链残段可能与一抗或/和二抗结合影响最终着色,因此在选择染色切片时应避免选择坏死组织较多的切片。
附实验小 Tips
