Nature 子刊:高彩霞团队开发可预测的精细下调目标基因蛋白表达的新方法
丁香学术
基因编辑技术在植物中的开发和应用为分子设计育种带来了革命性的变化。基于基因编辑技术建立基因精细调控的方法对于精准设计育种至关重要。目前应用最为广泛的基因表达调控方法,如 CRISPR-Cas、CRISPRi 和 RNAi 等技术只能够实现对基因的完全敲除或将基因的表达抑制到不可预测的水平。
利用 CRISPR-Cas9 技术对启动子区域进行编辑,可以在转录层面将基因的表达调控至不同的水平,并产生大量不可预测的数量性状变异。但这种方法将耗费大量精力用以筛选理想的突变体。因此,开发新的能够可预测地精细调控基因表达的方法可以极大拓展现有的基因表达调控工具箱,为作物遗传改良提供有力的技术支撑。
上游开放阅读框(uORF)是真核生物 mRNA 上普遍存在的翻译调控元件,对基因主效开放阅读框 (primary open reading frame, pORF) 的翻译具有抑制作用。
2018 年,中国科学院遗传与发育生物学研究所高彩霞研究组率先利用 CRISPR-Cas9 技术对 uORF 进行编辑,建立了精细上调内源基因翻译的方法,并利用该方法培育出了维生素 C 含量显著提高的生菜种质。2020 年,高彩霞研究组又将这一技术应用于草莓的遗传改良,获得了梯度糖分的系列草莓新种质。
2023 年 3 月 9 日,高彩霞团队在 Nature Biotechnolgoy 期刊发表了题为:Tuning plant phenotypes by precise, graded downregulation of gene expression 的研究论文。此前研究基础上,通过对上游开放阅读框(uORF)进行设计,开发了能够可预测地精细下调目标基因蛋白表达的新方法,为未来的分子设计育种提供了重要的技术手段。

上游开放阅读框(uORF)的长度及 uORF 与 pORF 之间的距离等多种因素都会影响 uORF 对 pORF 翻译的抑制能力。因此,研究团队猜想可通过以下两种策略抑制目标基因的翻译:第一种是在目标基因的 5' 非翻译区(5'UTR)从头产生新的 uORF;第二种是原位突变内源 uORF 的终止密码子以延伸其表达框长度。原生质体瞬时系统的结果表明这两种策略可以有效地将 pORF 的翻译抑制到不同的水平,且对其 mRNA 的表达量几乎没有影响。此后,研究团队利用碱基编辑和引导编辑系统获得了含有新创制 uORF 或内源 uORF 被延伸的水稻突变体植株,通过对突变体植株的蛋白表达水平和表型进行检测,发现突变体中引入的 uORF 变体对目标蛋白表达和表型的影响与瞬时系统结果一致。
为了实现对目标基因的表达进行连续的梯度下调,该研究结合以上两种策略,分别在水稻的 OsTCP19、OsTB1 和 OsDLT 基因的 5'UTR 区域设计了一系列具有不同抑制能力的 uORFs,瞬时系统的结果表明 pORF 的翻译水平被梯度地抑制到了原始水平的 2.5%-84.9%,实现了对基因的梯度敲降。OsDLT 基因编码 GRAS 蛋白家族成员,参与了水稻油菜素内酯信号转导途径,调控水稻株高、分蘖数、种子大小等多个重要农艺性状。该研究中以 OsDLT 基因为靶标,通过编辑 OsDLT 基因的 5'UTR,获得了一组具有不同叶夹角、株高和分蘖数的突变体,且突变体的表型变化趋势与瞬时系统预测结果一致。
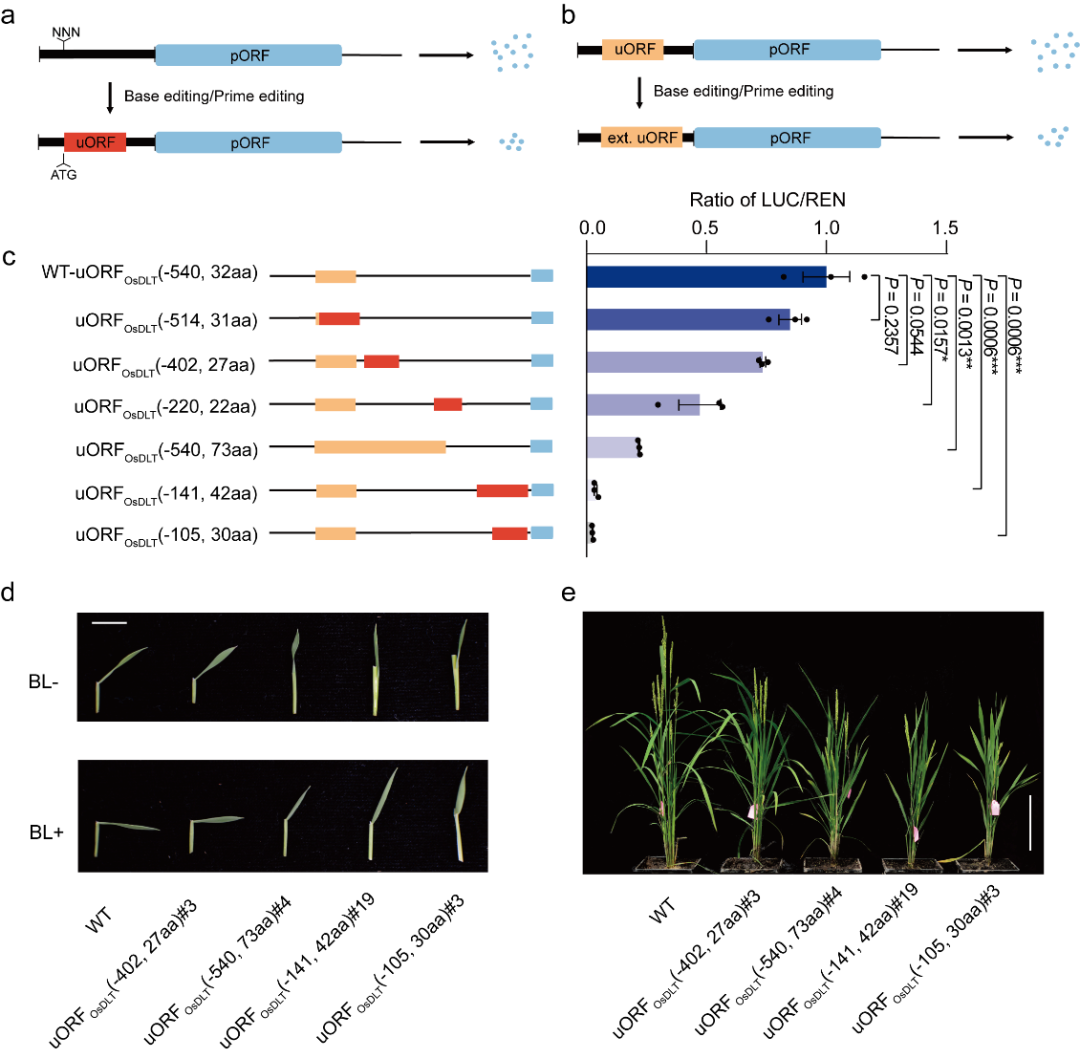
通过编辑 uORF 培育具有目标性状的水稻植株。(a, b) 从头创制新的 uORFs (a) 或延伸内源 uORFs (b) 抑制目标基因的蛋白表达。(c) 通过产生一系列具有不同抑制能力的 uORFs 梯度下调基因的表达。(d, e) 含有 uORFs 变体的突变体对油菜素内酯的敏感性 (d) 和植株表型 (e)。
综上所述,该研究通过对 uORF 进行设计,开发了一种普适的能够可预测地精细下调基因表达的新方法,为未来的分子设计育种提供了重要的技术手段。
高彩霞研究组博士后薛郴销为该论文的第一作者,高彩霞研究员为通讯作者。该研究得到国家重点研发计划项目、中国科学院战略重点项目、中国农业农村部等的经费资助。
论文链接:
https://doi.org/10.1038/s41587-023-01707-w