Science 子刊:清华廖学斌、胡小玉等联合团队开发免疫检查点阻碍疗法增敏新方法
免疫疗法
免疫疗法的兴起为多种类型癌症的治疗开辟了新的道路,大部分免疫治疗策略在临床实践中都产生了良好的反应,肿瘤组织的生长得到有效抑制,患者也能够在较长时间内保持症状的缓解。
这些免疫疗法中的一大部分依赖于阻断 T 细胞或其它免疫细胞表面的抑制性受体,从而导致细胞的活化以及对肿瘤细胞的杀伤,其中包括在临床应用中取得较大成功的 PD-1,PD-L1,CTLA-4 抗体等。然而,在临床治疗中发现仅有部分患者能够对单独的免疫阻断类药物产生积极反应,因此多靶点联合用药,增敏免疫检查点阻断成为了值得尝试的新型方案,引发了研究的热潮。

图片来源:Science Translational Medicine
针对这一问题,来自清华大学药学院的廖学斌教授课题组、清华大学医学院胡小玉教授课题组、美国新泽西理工学院 Zhi Wei、加州大学圣迭戈分校(UCSD)Wei Wang 等团队联合攻坚,成果发表于 Science Translational Medicine 杂志,题为 Enhancing KDM5A and TLR activity improves the response to immune chechpoint blockade。
该研究结合目前公开的癌症转录组学数据,揭示了 KDM5A 基因的活性是预测癌症患者接受 PD-1 疗法治疗后效果的有力指标。此外,通过建立建立了小鼠肠癌与黑色素瘤的模型,探究了 KDM5A 与 PD-1 治疗效果之间的关联。最终,通过小分子化合物库的建立以及高通量筛选,鉴定得到了一种能够有效提高 KDM5A 与 PD-L1 表达水平的药物前体,并证明其对 PD-1 抗体治疗的促进作用。
研究背景:
以往研究多集中于寻找免疫细胞表面的靶点分子,而众所周知,肿瘤细胞也存在显著的表观遗传学改变,其中包括一种称为「H3K4me3」的 DNA 甲基化修饰,这一变化影响了肿瘤细胞内部的基因表达特征。一类叫做「KDM5A」的去甲基化没能够对 H3K4 位点的双甲基化以及三甲基化修饰进行定向去除,而不会影响同一位点的单甲基化修饰。此前研究表明,KDM5A 是多种类型癌症的致癌基因,并且其活化伴随着肿瘤的发生以及恶化。因此,KDM5A 同样具有作为癌症治疗靶点的潜力。
许多研究表明,组蛋白的甲基化以及去甲基化修饰过程参与了肿瘤对 PD-1/PD-L1 疗法耐受性的产生。例如,抑制 KDM1A(一类去甲基化酶)的活性能够增强 PD-1 抗体抑制黑色素瘤生长的效果。与此同时,尽管 KDM5A 在生理学以及疾病发生过程中具有同样重要的意义,但其活性对于肿瘤免疫治疗的的影响仍不得而知。
主要内容
KDM5A 基因表达水平与黑色素瘤患者接受 PD-1 治疗后效果之间存在相关性
为了探究 KDM5A 与肿瘤免疫治疗有效性之间的关系,作者首先分析了 703 份黑色素瘤患者的及基因表达数据,并将其按 KDM5A 的表达水平由高到低进行排序。结果表明,KDM5A 表达量最高(前四分之一)的集合相比 KDM5A 表达量最低(后四分之一)的集合,存在 20 个差异较大的基因簇,而 PD-1 相关基因簇位列第二。
为了探究 KDM5A 表达水平能否准确预测 PD-1 治疗效果,作者分析了两份彼此独立的,公开的 RNA-seq 数据库样本,将其基因表达水平由高到低排序,并将患者按 PD-1 治疗效果分为响应组与不响应组。结果表明,不响应组中 KDM5A 的表达水平明显低于响应组。
此外,作者发现 KDM5A 高表达组患者的总体生存率以及无进展生存率均明显高于地表达组患者。随后,作者通过建立小鼠黑色素瘤以及大肠癌模型,并人为调控 KDM5A 的的表达水平,发现 KDM5A 活性的上调确实能够提高 PD-1 的治疗效果。
综上,作者认为 KDM5A 可以作为潜在的预测 PD-1 治疗效果的分子指标。
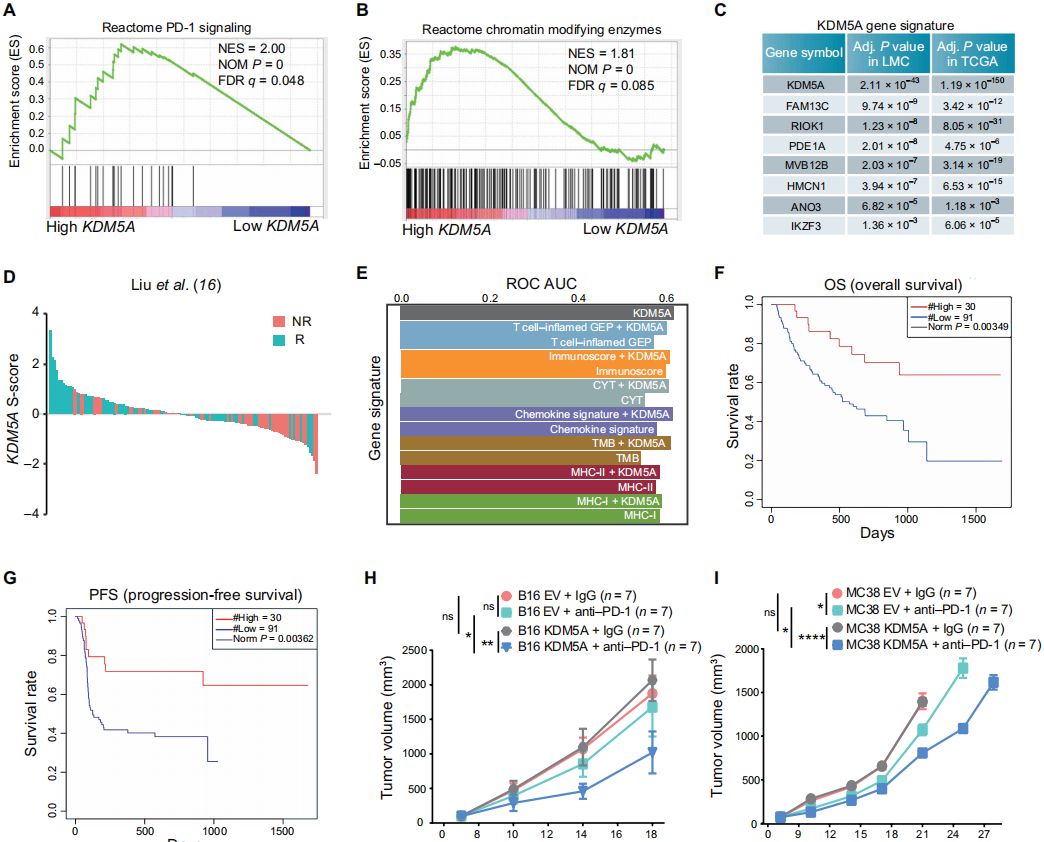
图片来源:Science Translational Medicine
KDM5A 提高 PD-L1 表达水平及其分子机制
为了探究 KDM5A 提高 PD-1 治疗效果的内在机制,作者首先进行了定量蛋白质组学分析。结果表明,KDM5A 的高表达会促进 11 种蛋白质的丰度,并且下调了五种与 PI3K-AKT-S6K1 信号相关的蛋白质的丰度。此前研究表明,PTEN 能够抑制 PI3K-AKT-S6K1 的信号活性,进而抑制 PD-L1 的产生。考虑到 KDM5A 本身的去甲基化酶活性,作者进行了染色质免疫共沉淀(CHIP)分析,发现 KDM5A 能够与 PTEN 启动子区域结合,进而下调了该区域 H3K4 三甲基化的水平。RT-PCR 检测结果证实了 KDM5A 的过表达会抑制 PTEN 的转录。进一步,作者通过一系列生化手段证明了 PTEN 的抑制能够促进 PD-L1 的产生。
总之,上述实验结果表明 KDM5A 能够通过下调 PTEN 的表达水平,促进 PD-L1 的产生,这解释了在 KDM5A 活性增强的条件下,PD-1 治疗效果能够得到大幅改善的原因。
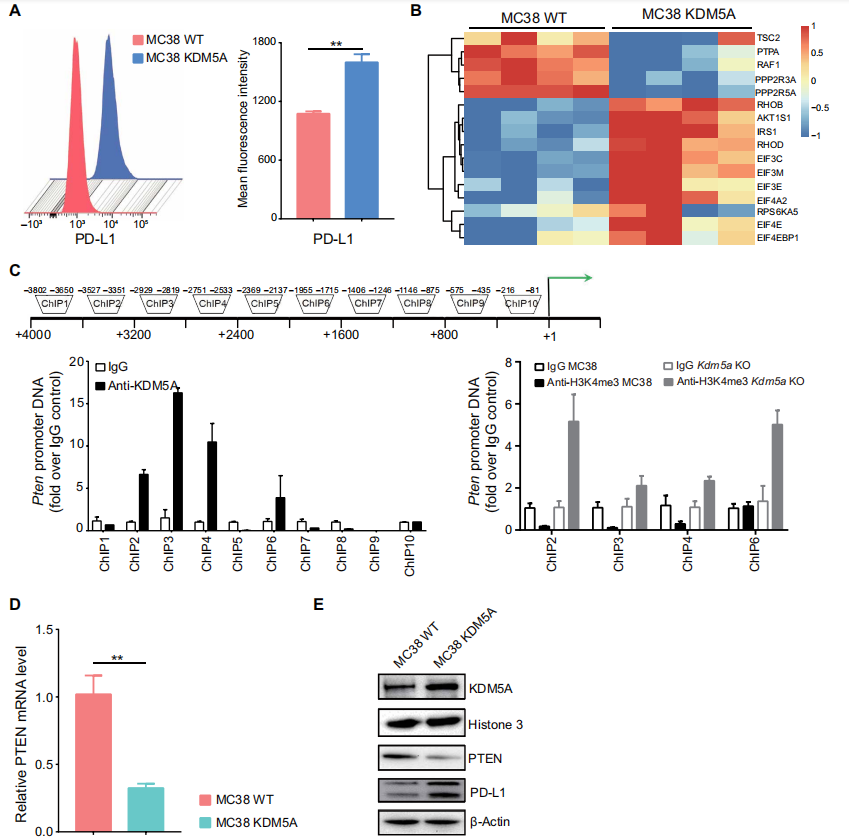
图片来源:Science Translational Medicine
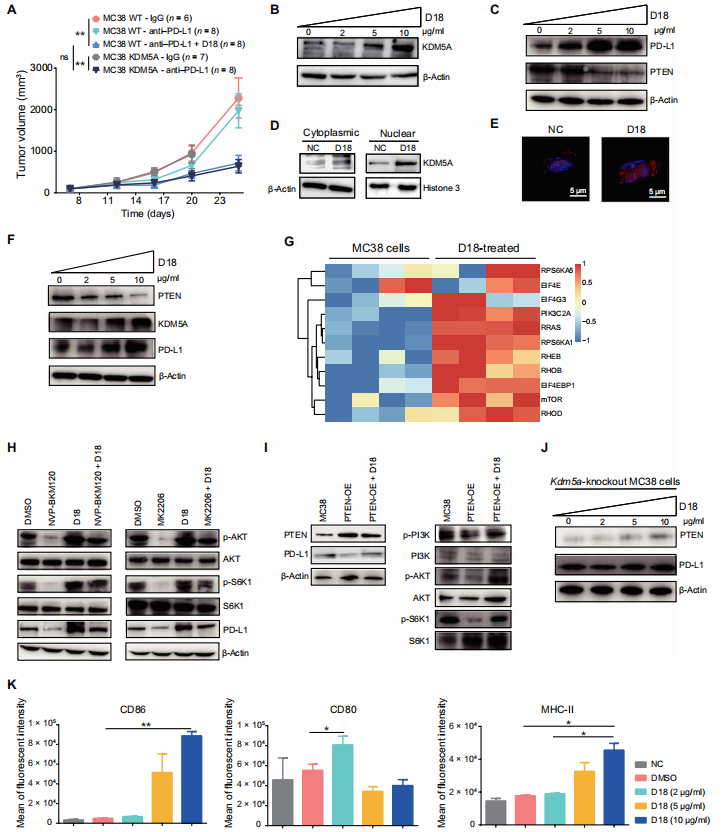
小分子「D18」增强 KDM5A 以及 PD-L1 的表达水平
基于上述结果,作者尝试寻找能够刺激肿瘤细胞提高 KDM5A 表达水平的方法。首先,作者对 FDA 已经批准的 1154 类药物进行筛选,得到了 18 种能够提高 KDM5A 以及 PD-L1 表达水平的药物,其中一种叫做「 palbociclib」的药物(CDK4/6 抑制剂)此前曾被用于癌症相关临床试验。对此,作者进行了体内实验。结果表明,palbociclib 能够一定程度上增强 PD-1 的治疗效果。
图片来源:Science Translational Medicine
由于此前研究发现 TLR7/8 激动剂与免疫检查点抑制剂联合使用能够产生有效杀伤肿瘤的效果,因此,作者对他们此前开发的 TLR7/8 激动剂小分子化合物库同样进行了高通量筛选,并最终得到了一种叫做 D18 的化合物。实验结果表明,D18 能够有效增强肿瘤细胞中 KDM5A 的去甲基化活性,进而能够促进 PD-L1 的表达水平。另外,考虑到 TLR7/8 的激活本身能够刺激宿主天然免疫信号活性,因此该分子能够在促进 PD-L1 表达量上调的同时提高肿瘤组织局部的炎症信号,从而更加有利于免疫系统的活化以及对肿瘤细胞的杀伤。
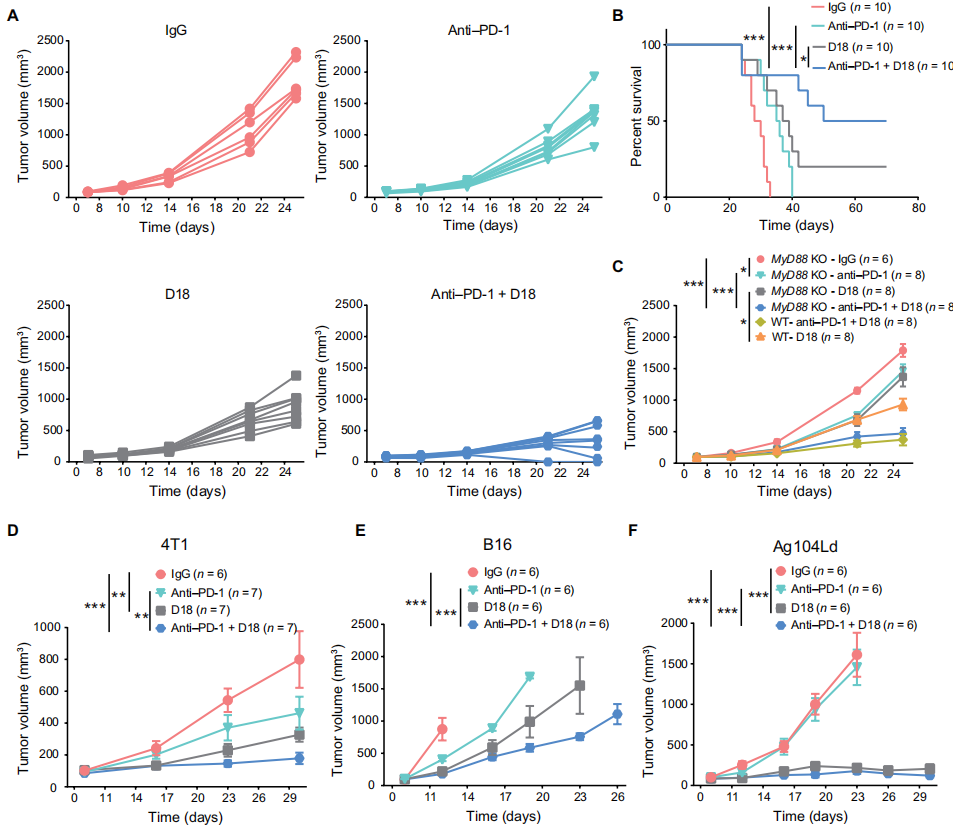
D18 与 PD-1 抗体联合用药可有效杀伤多类肿瘤
最后,作者通过建立的小鼠肠癌与黑色素瘤模型,探究了 D18 联合 PD-1 抗体在治疗癌症方面的作用。结果表明,D18 的加入能够显著提升 PD1 的治疗效果,肿瘤组织得到了进一步的缩小,小鼠寿命也得到了明显的延长。此外,作者发现 D18 的联合使用能够进一步提高 Th1 细胞,杀伤性 CD8 T 细胞,CD103 树突状细胞以及 M1 型巨噬细胞向肿瘤组织的浸润,表明该联合疗法能够有效改变肿瘤微环境,使得免疫系统能够起到更好的杀伤作用。
图片来源:Science Translational Medicine
总结
基于上述实验结果,作者揭示了 KDM5A 的去甲基化活性对于肿瘤细胞(肠癌以及黑色素瘤)均响应 PD-1 治疗的内在机制,并强调了其作为预测患者响应 PD-1 治疗效果的潜力。其次,通过构建小鼠肠癌与黑色素瘤模型,作者证实了通过调节 KDM5A 活性能够起到改善 PD-1 治疗效果的目的。通过小分子化合物库的高通量筛选,最终揭示了 D18 与 PD-1 联合治疗的对于进一步提高特定肿瘤免疫治疗效果的影响。综上,该研究为提高肿瘤免疫治疗的成功率提供了新的思路,或许将使更多的患者受益。