重组蛋白表达的目的蛋白分子量小于预测的原因?
丁香实验
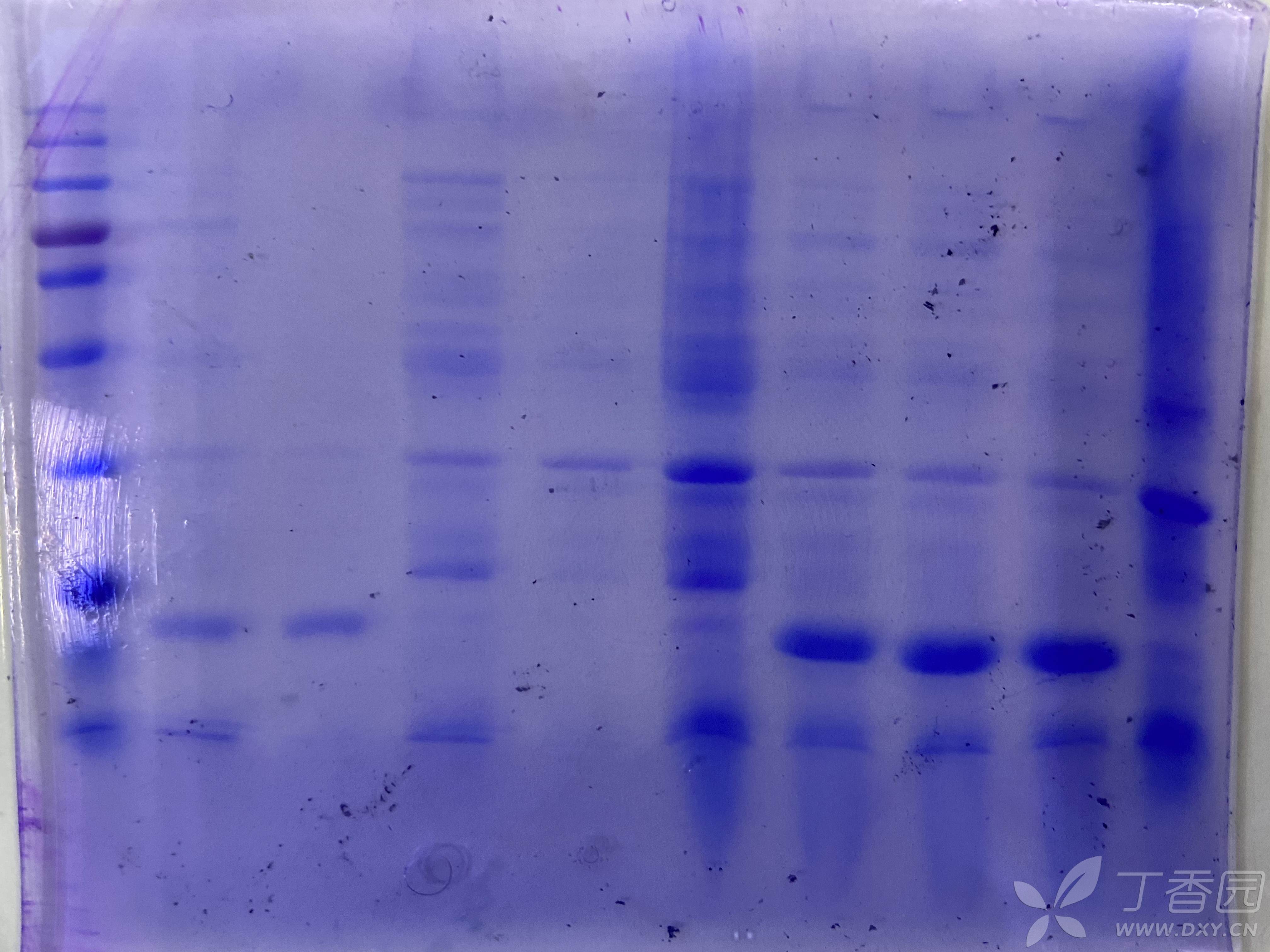
我用的pET-32a载体原核表达目的蛋白,双酶切测序验证了质粒没有问题,但是IPTG诱导后SDS跑出来的带比预测的蛋白分子量小10多KD,预测是38KD,但SDS里不到25KD,测序结果有一个碱基突变了,氨基酸也变了,但是没有生产终止密码子,存在很多稀有密码子,但是BL21和Rosetta感受态都试过了跑出来的条带一样,不知道问题出在哪?如何解决 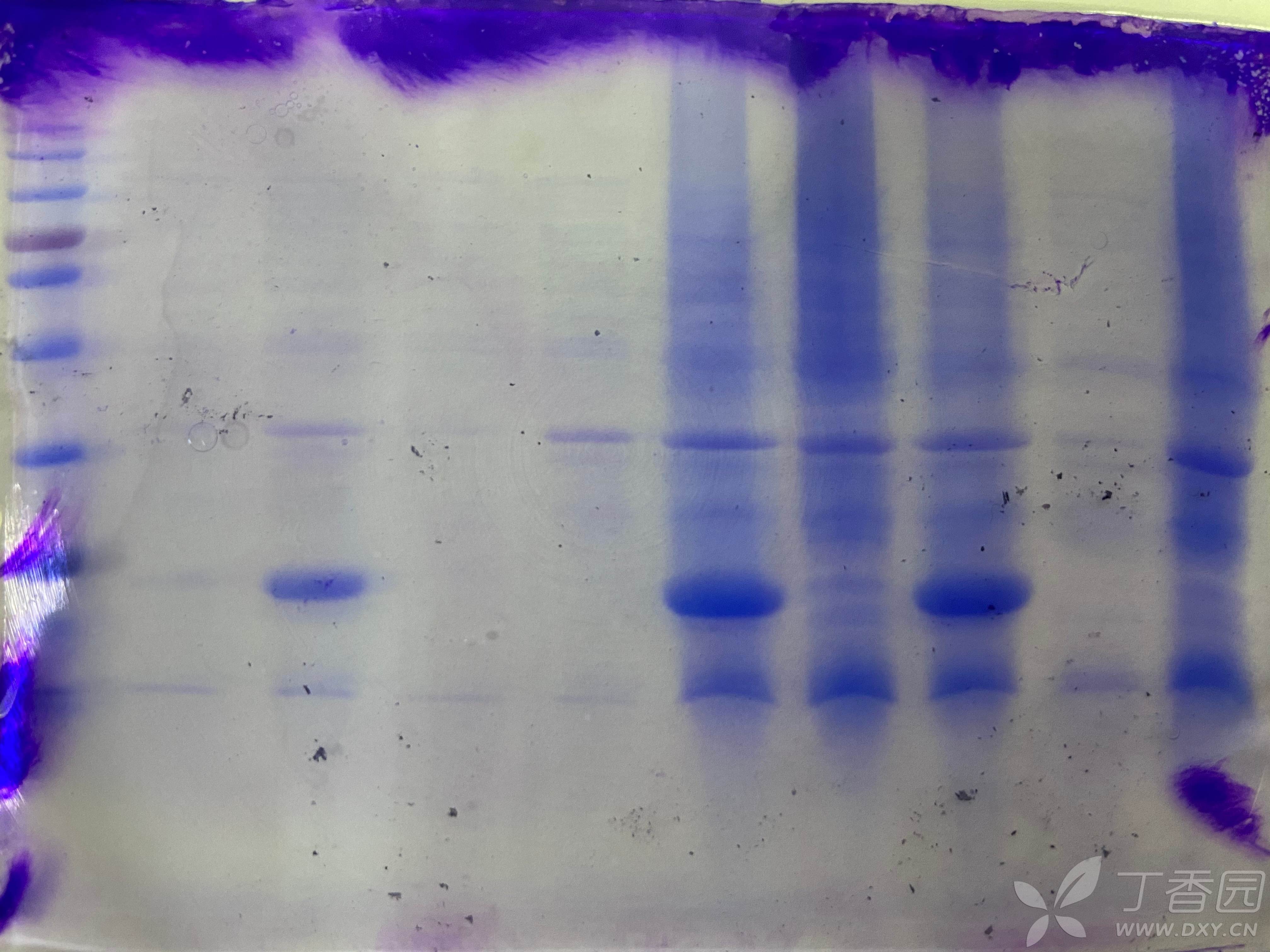
分享
28 个回答
dxy_e0cuvey7
有帮助
呜呜呜 有没有找到原因和解决办法呀呀?我的也一样少了10kd
是小杨同学
有帮助
我觉得是蛋白质本身被降解了,还有是不是质粒构建的问题呢
dxyhsx123
有帮助
第二次出现突变,很可能导致蛋白的一些性质发生变化,建议优化密码子,剔除突变进行确认。PS:预测和实际存在一定的偏差也正常。
lzy必有我师
有帮助
蛋白本身被降解了,可以存在一些不利于该蛋白稳定的蛋白酶,在尽可能不影响目标蛋白结构的情况下,选择合适的标签,通过标签蛋白的高产量强启动表达带动目标蛋白的表达。
JCorona
有帮助
不知道是题主表达前后矛盾还是我理解有问题,前面说测序验证了没问题,后面又说测序结果有突变。如果存在突变那就重新构建质粒啊,虽然没有产生终止密码子,但你也说了氨基酸已经发生了变化,这可能导致翻译后修饰变化的。
医往情深丁香园
有帮助
建议做一下密码子优化,还有可能是因为三维结构之类的原因,可以尝试带chaperone表达质粒的感受态,或者更换成昆虫细胞等更高等的表达体系
dxy_bq4uxnd
有帮助
预测大小和实际大小不一致有时是正常现象,蛋白质的形成过程中存在着修饰的过程,预测25kda,实际38kda,可能是蛋白质还没有被修饰。
dxy_qkedgrg7
有帮助
我觉得可能是序列有问题,最好重新构建一个,测序后没有突变了再做纯化
一支肾上腺素
有帮助
原因估计是由于修饰或降解等原因,有可能与预测大小有偏差。
内科小护士
有帮助
蛋白本身被降解了,可以存在一些不利于该蛋白稳定的蛋白酶,在尽可能不影响目标蛋白结构的情况下,选择合适的标签,通过标签蛋白的高产量强启动表达带动目标蛋白的表达。
zxb597
有帮助
可能在重组过程中,剪切时有误,受体中有影响分泌量的因素,蛋白质分子量的计算方法等。
dxy_h7vcp8v3
有帮助
如果验证构建质粒没有问题,目的蛋白跑胶小了10kD 首先,吧蛋白胶图的蛋白条带切胶去送质谱检测是否是你的目的蛋白,如果不是,重新用别的质粒进行构建克隆重新实验;如果是自己目的蛋白的一部分,可以分析得到的序列,检查是否自己基因序列表达的时候会在宿主细胞中断裂等等。。建议,更换载体,再次进行表达。检测看是否还会小10kd左右。
dxy_rlratyf3
有帮助
我不清楚你具体要表达的蛋白,但是有以下几个猜测:
1. 原目的蛋白存在多个亚基,突变后负责亚基间二硫键形成的残基缺失或移位,亚基无法连接导致电泳条带变小。
2. 目的蛋白高级结构过于复杂,电泳前或电泳步骤破坏了一些高级结构,使蛋白降解。
ZZDX-YILILI
有帮助
1.有没有这种可能性:你的目的蛋白质是多聚体?
2.免疫印迹确认一下,再考虑换载体或者菌株。
dxywode
有帮助
酶切鉴定时目的条带一般都要淡于载体带,因为带的亮淡是和核苷酸的量有关的,核酸多掺入的EB量就大亮度就高,所以在摩尔数相同的情况下,分子量大的片段就会相应的亮一些。如果测序确定是正确的就是插进去了,和酶切条带的亮弱没有关系,因为你挑的是单克隆提取质粒,所以其中的菌的性质是一致的,即如果菌落PCR和酶切鉴定的结果表明含有重组质粒就每一个菌都含。诱导表达没有明显的表达带是很常见的,SDS-PAGE的分辨率是有限的,表达量小的时候是看不到明确的表达带的,需要用western进一步鉴定,如果是隐性结果才能说没有表达。改变诱导条件是有可能改变表达效果的,你可以从诱导温度、IPTG浓度、起始诱导菌浓度等几个方面进行改进。但也可能你的蛋白就是在这个表达体系中无法表达,需要更换表达载体或表达菌株;如果目的蛋白对细胞的毒性比较大的话,在大肠杆菌中无法表达,可以改用酵母或是哺乳动物细胞进行表达,可能效果比较好。
于小闹0808
有帮助
考虑一下目的蛋白存不存在切割,等电点是多少,是否确认该条带就是目的条带
jey1235
有帮助
兄弟,恭喜你,如果你用Ni柱纯化,这个25KD蛋白压根就不是你要的,这是大肠杆菌的一个分子伴侣,名字我忘记了。
给你简单教一下:pET32a 不知道你用的什么tag ,假设tag-A,快去买个抗体做一下WB,一目了然。
另外,针对你的纯化,看起来是没有表达,换个载体吧,MBP, GST,SUMO,Trx 都是不错的选择,另外查查蛋白Cys多不多。
z流沙z
有帮助
质粒构建是否有问题?建议用高保真酶pcr,构建好后测序验证
dxy_pni5ki46
有帮助
氨基酸改变了可能引起蛋白结构稳定性的变化,你可以看看到突变位点前的氨基酸有多少个,分子量预测是多大
dxy_4uyyu09r
有帮助
建议先把突变的载体重新该回来吧,确保没问题的情况下还是这么大小的蛋白,有两种可能要么是蛋白翻译后又发生了切割,要么是自我折叠后影响了蛋白的大小测定,所以说预测大小并不一定是准确的,实际大小才正常,这个很常见的
相关产品推荐
相关问答
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序





