Cell Rep Med:中山大学项鹏 / 邓春华团队联合开发基因疗法恢复小鼠睾酮分泌与生育能力
丁香学术
睾丸间质细胞(Leydig cell,LC)合成分泌了男性体内超过 95% 的睾酮,对维持男性性征、内分泌稳态及生殖功能至关重要。当基因突变损害 LC 的正常功能引起睾丸间质细胞衰竭(Leydig cell failure,LCF),则会导致睾酮缺乏、性发育异常和男性不育。外源性睾酮补充虽能部分恢复患者的血清睾酮水平,但会引起多种严重的不良反应,且进一步抑制精子生成。因此,亟需寻找替代疗法。
LCF 的根本原因是参与睾酮合成的基因存在缺陷,基因治疗是最具潜力的策略之一。腺相关病毒(Adeno-associated virus,AAV)具有组织细胞靶向性、免疫原性低以及非整合性等多种优势,在基因治疗中发挥重要作用。但 AAV 介导的基因疗法治疗 LCF 的可行性、安全性及有效性如何,尚未见报道。
2022 年 10 月 20 日,中山大学中山医学院项鹏团队联合中山大学附属第一医院邓春华团队,在 Cell Reports Medicine 发表了题为 AAV-mediated gene therapy produces fertile offspring in the Lhcgr-deficient mouse model of Leydig cell failure 的研究论文。该研究首次完成了基因治疗 LCF 的概念验证:证明 AAV 介导的基因疗法可恢复 LCF 小鼠的睾酮产生、重启生殖系统发育、促进精子生成并产生健康可育后代;上述结果表明基因疗法有望成为治疗 LCF 的有效方法,具有潜在的临床应用价值。
在该项研究中,研究人员首先使用 Lhcgr 失活突变(Lhcgr-/-)的小鼠 LCF 模型对多种不同血清型 AAV 进行测试,筛选出对睾丸中 LC 细胞靶向性和转染率最高的血清型—AAV8。随后,研究人员构建了编码小鼠 Lhcgr 序列的 AAV8 载体(AAV8-Lhcgr),并发现青春期前 Lhcgr-/- 小鼠经过 AAV8 介导基因治疗后,血清睾酮水平增加、性发育启动、精子生成显著增加(促进圆形和长形精子细胞形成),并可以产生健康子代。更有意思的是,这些子代小鼠具有正常的生育能力,并能通过自然繁育产生第二代小鼠。同时在子代中未检测到任何 AAV8 载体序列信号,证明了 AAV 疗法的生殖安全性。
研究人员观察到基因治疗 6 个月后,Lhcgr-/- 小鼠的生殖表型仍有明显恢复,表明通过单次基因治疗有望获得长期改善。
临床上,大部分 LCF 患者直到成年后才被诊断出来,错失最佳治疗机会。该研究还发现,AAV 介导的基因疗法对成年小鼠与青春期前小鼠一样有效,例如睾酮分泌增加和性发育的重新启动、附睾尾中出现大量精子等。表明该疗法有望满足诊断时已成年并且面临巨大生育压力患者的迫切需求。
基于上述良好的治疗效果和安全性,研究人员推测 AAV 介导的基因疗法也可能应用于其他类型的遗传性 LCF,如 3β-羟基类固醇脱氢酶 2 型(3β-HSD2)缺乏症、细胞色素 P450 氧化还原酶(POR)缺乏症、17α-羟化酶(CYP17A1)缺乏症、17β-羟基类固醇脱氢酶 3 型(17β-HSD3)缺乏症等。此研究为 LCF 的治疗提供了新的思路,并有望以个性化的方式应用到 70 多种遗传性性腺功能衰竭等疾病的治疗中。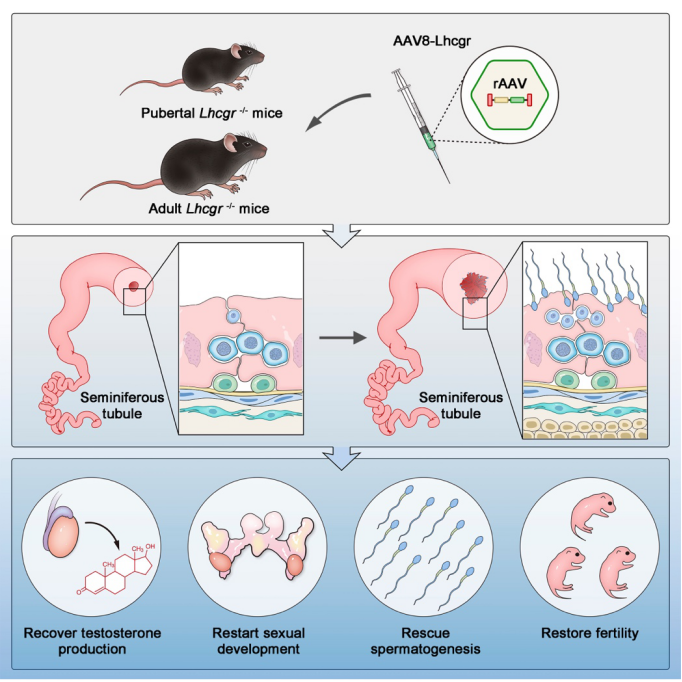
综上所述,本研究证实了 AAV 介导的基因治疗遗传性 LCF 的可行性、安全性和有效性,为遗传性 LCF 基因药物的研发奠定了重要基础。
中山大学中山医学院项鹏教授和中山大学附属第一医院邓春华教授为共同通讯作者,团队成员夏凯、汪富林、赖兴强和董琳为并列第一作者。中山大学眼科中心毛富祥教授、中山大学柯琼副教授、路易斯维尔大学医学院 Zhenmin Lei 也对此研究做出了重要贡献。该工作得到了科技部、国自然基金委、广东省科技厅等研究经费的支持。