比起脂肪,糖才是让人肥胖的真凶?Cell 揭示食物中的糖如何「改造」肠道促肥胖
丁香学术
导读
肥胖和代谢综合征是复杂的生理状况,会导致许多病理性改变,包括心血管疾病、中风和 2 型糖尿病(T2D)。饮食结构是肥胖和代谢综合征发病率增加的一个主要因素,如西式高脂肪饮食(HFD)会引发一系列健康问题,最终导致肥胖和肥胖相关的代谢并发症。虽然人们对这些疾病的后期病理生理学了解甚多,但疾病如何发生尚不完全清楚,饮食中的不同成分在其中的作用也还未被解析。
微生物群是肠道免疫的重要调节因子,微生物群可以通过调节免疫反应影响代谢综合征。不过,代谢综合征中调节宿主免疫的饮食和微生物种类,以及相关的细胞和分子机制尚不清楚。
2022 年 8 月 29 日,来自美国哥伦比亚大学等单位的科研人员在 Cell 发表了题为 Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome 的文章。他们重点研究了微生物调控的肠道免疫,发现微生物诱导辅助性 T 细胞 17(Th17)对饮食诱导的肥胖和代谢综合征具有保护作用。并确定了饮食中的糖会改变肠道微生物组,减少 Th17 细胞,进而引发体重增加以及一系列代谢性疾病的前期事件。
图片来源:Cell
主要研究内容
高脂饮食通过消除 Th17 诱导的微生物群而破坏肠道免疫稳态
为了确定代谢综合征的起始事件,研究人员在脂肪组织发生炎症改变之前的 4 周检测了高脂饮食(HFD)对肠道免疫稳态的影响。在小肠固有层(SI-LP)中,HFD 可导致 Th17 细胞的比例和总数显著下降,但对 Tregs 没有明显影响。此外,Th17 细胞 Rorgt 的表达也显著降低,表明 Th17 细胞功能的普遍丧失。细胞因子染色也显示 IL-17+ Th17 细胞的百分比和总数相应下降。这些结果表明,高脂饮食可导致肠道 Th17 细胞免疫特异下降。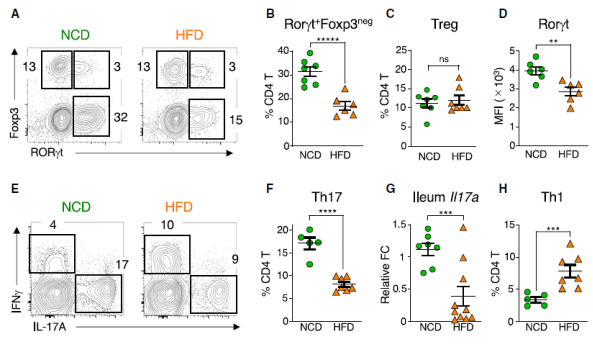
图片来源:Cell
前期的研究表明,共生菌群,特别是肠道分节丝状菌(segmented filamentous bacteria, SFB)可以诱导小鼠小肠固有层(SI LP)Th17 细胞的产生。因此,他们进一步研究了 HFD 是否影响 SFB 水平。
值得注意的是,HFD 导致了 SFB 的丢失,且 SFB 的丢失先于 Th17 细胞的丢失。并且,在缺失 Th17 细胞的动物中,SFB 的丢失依然发生。所以说 SFB 和 SFB 诱导产生的 Th17 细胞在高脂饮食后都丢失了。数据表明,HFD 诱导 Th17 细胞产生的菌群丢失而使 Th17 细胞显著减少,最终导致了 Th17 细胞在代谢综合征发生前的丧失。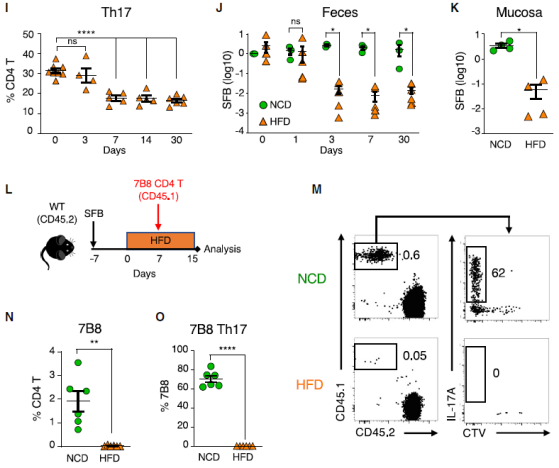
图片来源:Cell
益生菌诱导产生的 Th17 细胞可改善代谢综合征
接下来,他们尝试通过补充菌群诱导肠道 Th17 细胞的恢复,探索是否可以改善 HFD 导致的 DIO 和代谢疾病。
他们对 HFD 喂养的野生型小鼠每隔一天灌胃 SFB 或控制细菌,连续 4 周。外源添加 SFB 则可显著地恢复粪便内容物中的 SFB 水平,更重要的是,SFB 处理小鼠的 Th17 细胞显著恢复,体重增加也显著减少,并免受糖尿病前期表型的发展,包括胰岛素抵抗和葡萄糖耐受不良,同时也显示出 HFD 诱导的肠道炎症的改善。综上所述,通过添加 Th17 细胞的诱导菌群 SFB,可以诱导肠道 Th17 细胞的恢复,并且显著改善 DIO 和代谢综合征。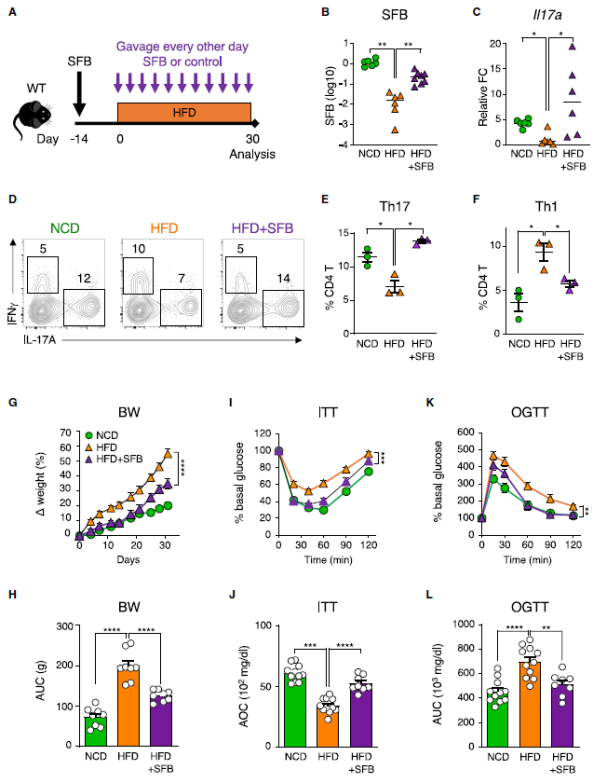
图片来源:Cell
膳食糖通过消除共生 Th17 细胞促进代谢综合征
接下来,他们研究了导致保护性共生体肠道 Th17 细胞缺失的膳食成分的主要性质。结果发现,以 50:50 的 NCD(正常饮食):HFD 混合并不能防止 SFB 的减少,这表明高脂饮食中可能含有一种「抑制」成分。因此,研究人员后续重点关注了高脂饮食配方中富集的成分。
除了膳食脂肪,高脂饮食中另一种高代表性成分是膳食糖。研究人员将蔗糖加入野生型动物的饮用水中,发现蔗糖可以以剂量依赖性的方式消除 SFB。通过检测蔗糖对肠道 Th17 细胞的影响,他们发现添加蔗糖会使得 SI-LP 中的 Th17 细胞减少,而且剩余 Th17 细胞的 RORgt 水平下降,表明功能也受到干扰。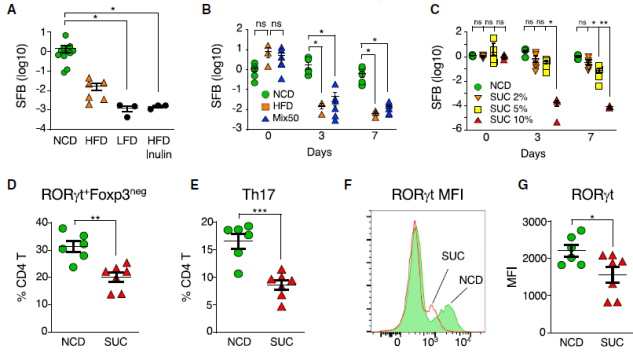
图片来源:Cell
为了研究膳食糖对 Th17 细胞的影响,他们用淀粉代替膳食中的蔗糖和麦芽糖糊精,产生了无糖 HFD(SF-HFD)饮食。与 HFD 组相比,SF-HFD 喂养的小鼠免受体重增加、胰岛素抵抗和葡萄糖耐受不良,并且保持了高水平的肠道 Th17 细胞。
为了证实 SF-HFD 的积极作用是由于不含糖,他们进行了一组单独的实验,其中一些 SF-HFD 动物的饮用水中加入 10% 的蔗糖。和以前一样,SF-HFD 喂养的动物维持了肠道 Th17 细胞,并改善了 DIO 和代谢综合征;然而,在喂食 SF-HFD 的小鼠饮用水中添加糖后,这种保护作用就完全消失了,变得与 HFD 喂养小鼠一样容易患肥胖和代谢综合征。
后续更加深入的分析结果表明,糖通过增加肠道菌群中的丹毒菌科成员,从而取代 SFB 并减少肠道保护性 Th17 细胞。
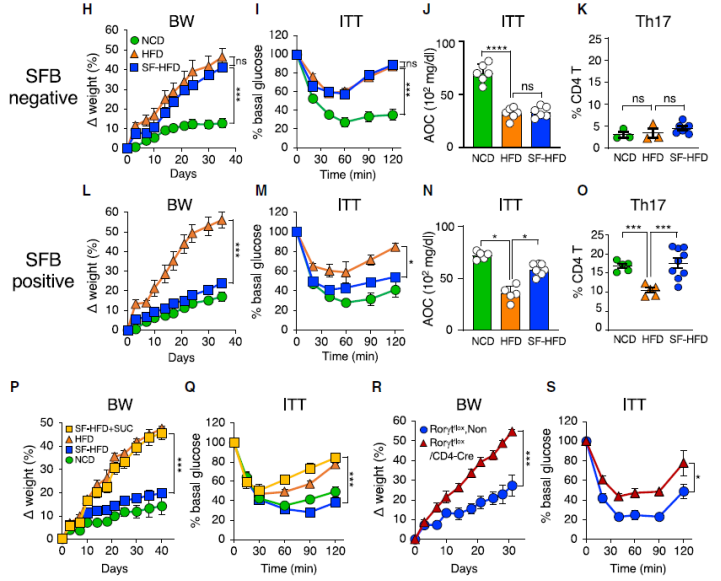
图片来源:Cell
共生 Th17 细胞通过调节肠道脂质吸收来预防代谢综合征
最后,他们研究了共生 Th17 细胞对代谢综合征提供保护的机制。在肠道中,膳食脂质的上皮吸收是代谢综合征的已知调节因子。IL-17 促进小肠上皮细胞间紧密连接的形成,参与调节肠道屏障功能。因此,他们研究了 Th17 细胞对肠道脂质吸收的影响。实验结果表明,Th17 细胞的存在降低了肠上皮细胞的脂质吸收,与脂质摄取和运输相关的几个基因表达也均下调,其中最显著的是 Cd36。
CD36 这是编码膳食脂肪酸进入细胞的转运体,上皮细胞 CD36 对膳食脂肪吸收有强大的作用,从而调节代谢综合征。CD36 在脂质分解的十二指肠和脂质吸收最多的空肠高表达,稳定状态下在回肠的表达较低。他们发现 SFB 定植特异性下调 CD36 基因在空肠和回肠的表达,而在十二指肠则不表达,并且 CD36 下调依赖于 Th17 细胞来源的 IL-17。总而言之,Th17 细胞可以通过 CD36 降低脂质摄取,并以 IL-17 依赖的方式降低远端肠道的脂质吸收。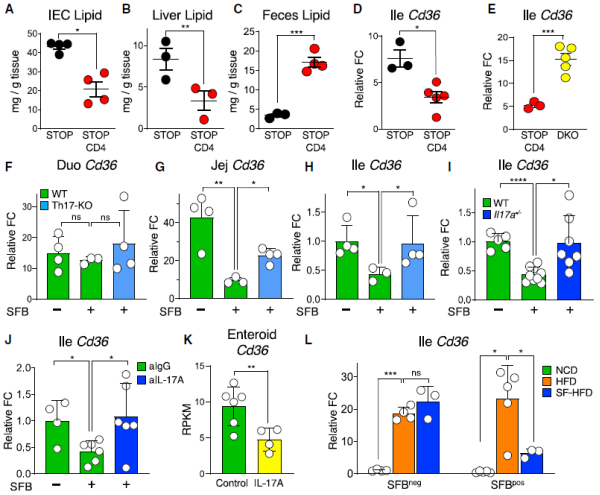
图片来源:Cell
结语
综上所述,该研究描述了膳食成分、微生物群和肠道免疫细胞之间复杂的互作网络,以此调节代谢状态。研究中发现,饮食中的糖是导致肥胖和代谢疾病的罪魁祸首。糖通过抑制免疫保护菌群,导致 Th17 细胞显著减少,引发一系列代谢性疾病、糖尿病前期和体重增加的事件。
当给小鼠喂食无糖、高脂肪的饮食时,它们保留了肠道 Th17 细胞,并完全免受肥胖和糖尿病前期的影响,即使它们吃了相同数量的卡路里。
此外,通过添加 Th17 细胞诱导菌群 SFB,可以诱导肠道 Th17 细胞的恢复,显著改善 DIO 和代谢综合征。这一证据表明,微生物调节可以为肠道免疫提供保护,因此应被认为是代谢综合征和 T2D 的关键治疗靶点,未来的精准医学治疗方法应该考虑免疫调节菌群的个体变化。