TUNEL 检测细胞凋亡原则及经验总结
Elabscience
一、TUNEL法的实验原理
细胞发生凋亡时, 染色体DNA双链或单链断裂产生大量的粘性3'-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3'-末端,从而可进行凋亡细胞的检测,这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal -deoxynucleotidyl transferase mediated nick end labeling, TUNEL)。由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3'-OH形成,很少能够被染色。由此,TUNEL成为了检测DNA片段化(细胞凋亡)的最常用方法。(以TUNEL法细胞凋亡检测试剂盒(增强型,绿色荧光)为例)
TUNEL检测:使用20 U/ml Dnase处理Hela细胞10分钟。
二、TUNEL实验中关键步骤
1. 充分脱蜡和水化。脱蜡前可先将切片在 60ºC烤片 20 min,再使用二甲苯脱蜡2次,每次 5-10 min;而水化一般建议用梯度乙醇从高浓度到低浓度浸洗,便于后期试剂能充分、均匀的结合反应。
2. 把握好细胞通透的时间。一般根据切片的厚薄,选择蛋白酶k的孵育时间,常用 10-30 min,几 μm 厚的切片用短时间;几十 μm厚的 切片用长时间,通过摸索达条件使实验过程做到既不脱片,也能够使后面的酶或抗体进入胞内。
3. 适当延长 TUNEL 反应液的时间。一般是37ºC孵育 1 h,也可以根据细胞的凋亡损伤程度,选择更长的时间,可长至 2 h,但要结合实验最终的背景着色来确定。
4. DAB 显色条件的选择。如果是用DAB显色,一般 DAB 反应不超过10 min,可结合显微镜观察控制背景颜色,有可能几十秒种就能显色。
5. PBS 的充分清洗。在 TUNEL 反应后和酶标反应后的清洗请严格遵守清洗条件,次数可增加到 5 次,以降低切片的非特异性着色。
6. 内源性 POD 的封闭。对于肝脏、肾脏等血细胞含量多的组织,可适当延长封闭时间和升高过氧化氢的浓度,可以达到较好的封闭效果,且不影响最终的特异性染色。
三、细胞通透的时间选择
1. 蛋白酶 k 的目的是通透细胞膜和核膜,从而使反应试剂能充分进入细胞核进行反应,提高阳性率。但浓度过高或孵育时间过长容易造成脱片,其作用类似与 TritonX100 等细胞通透剂。
2. 蛋白酶K一般工作液浓度为 20 μg/ml,亦可自行将浓缩液配制1-10 mg/ml。蛋白酶K可用 PBS 配制,也可用蛋白酶K缓冲液(100 mM Tris HCl pH8.0, 50 mM EDTA),分装后-20ºC保存。
3. 蛋白酶K反应时间一般为10-30 min,具体时间长短与切片厚薄有关,4 μm左右的片子可以通透 10 min,如切片厚度30 μm左右的可延长至30 min,需实验摸索最佳时间。通透时间过长易脱片、过短起不到通透效果。
四、关键试剂操作条件
1. DAB 显色反应大约需要30s-5 min,要控制好反应时间,勿使背景颜色过深。具体的可能还是得根据切片组织来源和切片厚度、试剂盒说明摸索条件。
2. 蛋白酶K工作液处理时间、温度须在范围内摸索,温度过高,时间过长,易造成脱片且可能破坏核酸结构,出现假阳性。
3. 阳性样本的DNase 1处理一般建议室温,10 min 即可。
五、如何减弱非特异性染色
肝脏或肾脏,因富含内源性过氧化物酶,需要增加过氧化氢浓度和延长孵育时间。其他还可以加强灭活、缩短 DAB 孵育时间、PBS 充分清洗,显微镜下把握好着色情况。
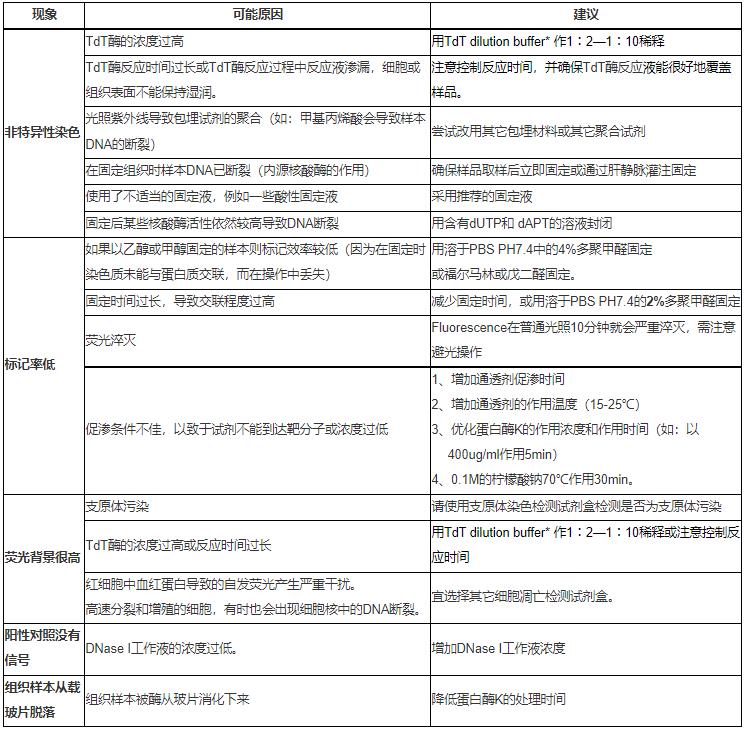
六、常见问题分析