Nature!中美学者共同破译粘附类 GPCR 自激活机制之谜
丁香学术
G 蛋白偶联受体(GPCR)作为目前已知的人类基因组中最大的膜蛋白家族,可谓是闪闪发光的「明星蛋白」,其负责 80% 左右的跨膜信号转导,参与调控人体中大多数病理与生理过程。据统计,目前世界药物市场上至少有三分之一的小分子药物是 GPCR 的激活剂或者拮抗剂,掌握了 GPCR 的精细结构便是获得了生命密码!
2012 年,诺贝尔化学奖众望所归地花落 G 蛋白偶联受体研究领域,两位美国科学家罗伯特·莱夫科维茨(Robert J. Lefkowitz)和布莱恩·克比尔卡(Brian K. Kobilka)因在「G 蛋白偶联受体研究」领域的开创性卓越贡献,获得了顶尖褒奖,其杰出工作令人振奋与敬佩。
2022 年 4 月 13 日,四篇解析 GPCR 前生今世之谜的 Nature 论文同日齐发,其中三篇论文出自我国科学家之手。江山代有才人出,我国的科研工作者们亦数十年如一日地在 G 蛋白偶联受体(GPCR)研究领域深耕,做出了不起的成果!

图 1:来源 Nature
一、解析 GPCR 自激活机制,让「孤儿」受体不再孤单
GPCR 家族是一个庞大的药物靶标蛋白家族,在细胞膜上充当「信号兵」的关键角色。目前已知的蛋白有 800 多种,其中约 100 多种是「孤儿受体」(黏附类受体)。顾名思义,孤儿受体即为与其结合的配体、信号和信号通路都未得到清楚解析,而这些受体极可能在人类生命健康中扮演着重要的角色,与精神分裂症、多动症或癌症相关!
2022 年 4 月 13 日,中科院上海药物研究所吴蓓丽团队、赵强团队联合上海科技大学水雯箐团队在 Nature 杂志发表研究论文 Structural basis of tethered agonism of the adhesion GPCRs ADGRD1 and ADGRF1,该研究成功解析两种黏附类 GPCR(adhesion GPCR)ADGRD1 和 ADGRF1 分别与 G 蛋白结合的复合物三维结构,在孤儿受体信号转导机制研究方面取得重大突破,助力发现新的药物靶点。

图 2:G 蛋白结合的 ADGRD1 和 ADGRF1 的整体结构图,来源 Nature
ADGRD1 和 ADGRF1 作为两种黏附类受体,被发现是多种癌症的致癌基因,但其在分子水平上如何被激活和调控,相关的作用机制仍不清楚,属于名副其实的孤儿受体。该研究利用冷冻电镜技术成功测定 ADGRD1 和 ADGRF1 分别与 G 蛋白结合的复合物结构,发现受体自身的一部分可作为内源性激动剂,使受体激活。
令人惊讶的是,该研究中充当激动剂的部分是位于受体胞外结构域和跨膜结构域之间的一段多肽(包含约 20 个氨基酸),被称为「stalk」,与跨膜结构域之间形成的相互作用力,对于受体激活具有至关重要的作用。
与此同时,研究者们发现了一种细胞膜的天然脂分子通过与 ADGRF1 特异性结合对受体功能进行调控,极大地拓展了对于 GPCR 功能调控机制的认识。
此项研究解析 GPCR 自激活机制,拓宽了对「孤儿」受体的认知,助力孤儿受体不再「孤单」,为新药研究领域再次添砖加瓦。
二、背靠背的 Nature 论文,阐明 aGPCR 自激活及对机械力感知的机制
在同一天,来自山东大学、西安交通大学的科学家们,和中科院上海药物研究所的科学家们会师,齐齐亮剑,共攀黏附类受体科研高峰!
2022 年 4 月 13 日晚 23 时,山东大学孙金鹏教授和于晓教授团队在 Nature 杂志背靠背发表两篇关于粘附类 G 蛋白偶联受体(adhesion GPCR,aGPCR)的研究论文:Structural basis for the tethered peptide activation of adhesion GPCRs 和 Tethered peptide activation mechanism of the adhesion GPCR ADGRG2 and ADGRG4,阐明 aGPCR 自激活及对机械力感知的机制,提出 aGPCR 激活的「手指模型」,并创新性构思出通用多肽配体拮抗剂的开发方案。
细胞内液体流动或者震动等机械力,刺激驱动着细胞的动态以及机体的正常生长运行。Stachel 序列介导的 aGPCR 激活作用一直是 aGPCR 信号和功能的核心内容,Stachel 序列如何与受体作用,调控受体激活状态的通用机制仍未明晰。在 Structural basis for the tethered peptide activation of adhesion GPCRs 工作中,研究者们回答了这一未解谜题。
孙金鹏教授团队解析了粘附类受体 GPR133 和 GPR114 结构,发现 GPR133 GPS 位点发生水解,在质膜上发生 NTF-CTF 分离,GPR114 不发生自水解,能够感知机械力。通过功能实验证明了受体感知机械力后通过 Stachel 序列激活受体,并确定 Stachel 中的 5 个疏水氨基酸组成的保守 HIM(Fss-03xφφφxφss-09),其在 Stachel 序列与受体相互作用中起着核心作用,对 Stachel 序列介导的粘附类受体机制有了深入了解。同时为 Stachel 序列外源短肽设计提供了依据,为靶向粘附类受体相关疾病的鉴定和治疗奠定了基础。
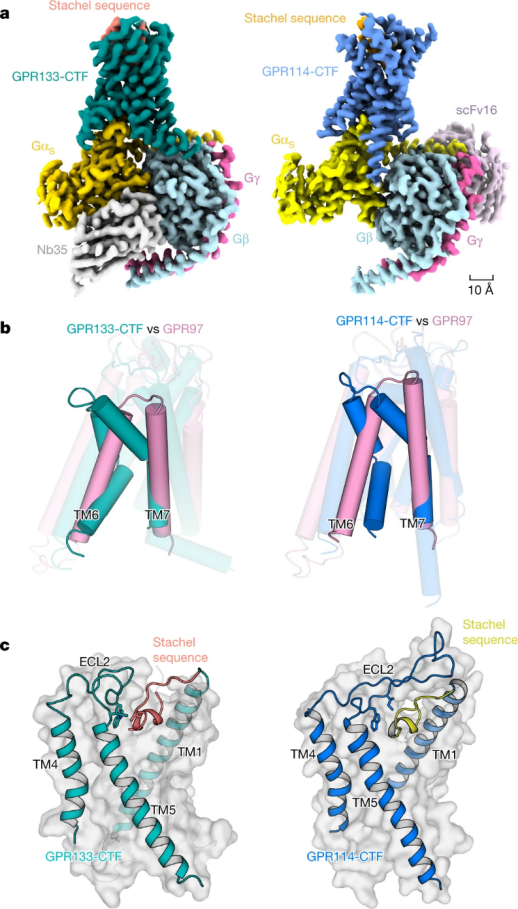
图 3:GPR133-CTF–Gs 和 GPR114-CTF–Gs 复合物结构,来源 Nature
在 Tethered peptide activation mechanism of the adhesion GPCR ADGRG2 and ADGRG4 工作中,研究团队通过冷冻电镜技术解析了 Stachel 序列激活的 ADGRG2-β-Gs 和 ADGRG4-β-Gs 的复合物结构,揭示了 Stachel 序列与 aGPCR 的直接作用机制,发现 Stachel 序列 5 个疏水氨基酸呈手指状分布,在 Stachel 序列介导的激活过程中起到主导作用,提出了 aGPCR 激活的通用「finger」模型激活模式,并命名为手指模型。
该项工作与中科院上海药物研究所吴蓓丽团队等的工作遥相呼应,充分地体现了科学之美。
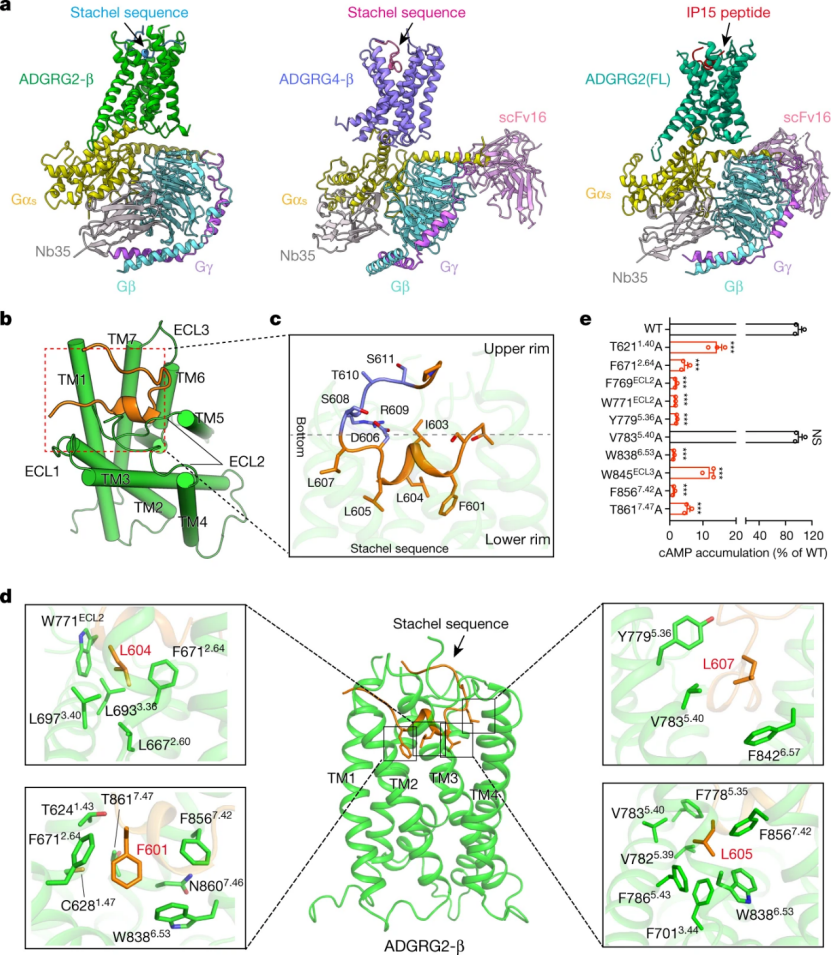
图 4:粘附 GPCRs ADGRG2 和 ADGRG4 的自激活机制,来源 Nature
三、遥相呼应,共探 aGPCR 自激活机制
GPCR 研究领域具有迷人的魔力,吸引着全世界的科学家们前赴后继地展开孜孜不倦的探索。
同一天,2022 年 4 月 13 日,来自美国加利福尼亚州斯坦福大学医学院 Georgios Skiniotis 研究团队在 Nature 杂志发表研究论文 The tethered peptide activation mechanism of adhesion GPCRs。
该项研究解析了 aGPCR 家族 GPR56(ADGRG1)和 latrophilin 3(LPHN3 或 ADGRL3)的高分辨率、G 蛋白偶联状态结构,发现 TA 肽可与七个跨膜结构域和茎环 2(loop 2)结合,具有显著的相互作用保守性。同时,TA 结合稳定跨膜螺旋 6 和 7 中间的断裂,促进 AGPCR 偶联和激活异源三聚体 G 蛋白,提出了 aGPCR 自激活的模型。
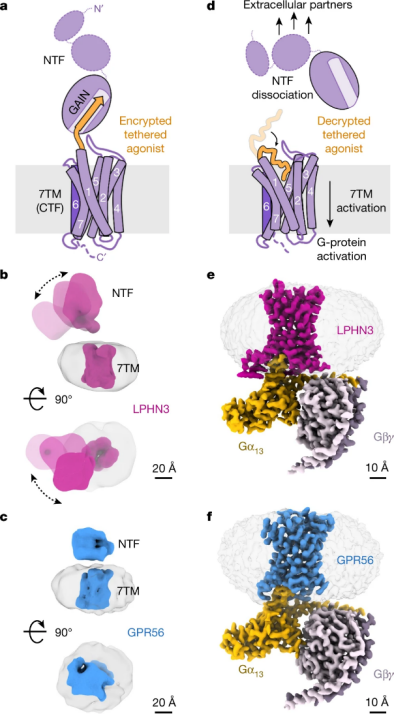
图 5:GPR56 和 LPHN3 结构,来源 Nature
一天之内四篇 Nature 论文同日齐亮剑,解开 aGPCR 的未解之谜,科学家们杰出的工作令人敬佩。
值得一提的是,赵强研究员和吴蓓丽研究员、孙金鹏教授和于晓教授,他们不仅是共攀科研高峰的好伙伴好战友,生活中两对夫妻更是令人艳羡的伉俪情深,数十年如一日地辛勤耕耘在 GPCR 受体的研究领域,携手书写着事业和生活的美好篇章。
GPCR 领域的进展势必为人类治疗疾病做出巨大的贡献,让我们拭目以待。
题图来源:站酷海洛
参考文献:
1. Qu, X., Qiu, N., Wang, M. et al. Structural basis of tethered agonism of the adhesion GPCRs ADGRD1 and ADGRF1. Nature (2022). https://doi.org/10.1038/s41586-022-04580-w
2. Ping, YQ., Xiao, P., Yang, F. et al. Structural basis for the tethered peptide activation of adhesion GPCRs. Nature (2022). https://doi.org/10.1038/s41586-022-04619-y
3. Xiao, P., Guo, S., Wen, X. et al. Tethered peptide activation mechanism of the adhesion GPCRs ADGRG2 and ADGRG4. Nature (2022). https://doi.org/10.1038/s41586-022-04590-8
4. Barros-Álvarez, X., Nwokonko, R.M., Vizurraga, A. et al. The tethered peptide activation mechanism of adhesion GPCRs. Nature (2022). https://doi.org/10.1038/s41586-022-04575-7