荧光定量 PCR——想要实验结果可靠,各种对照不可少
赛默飞
怎么整板都没有扩增曲线,是哪一步实验出问题了吗?
这个病原体这段时间怎么经常检出?不会是有污染了吧?
在您看到荧光定量 PCR 结果的时候是否也有过这样的疑问?隐隐约约感觉实验某个步骤出现问题,却又不知该从何下手。别担心,有「对照精灵」们来助您一臂之力。
荧光定量 PCR 实验,从样本采集到结果分析包含多个实验步骤,针对不同的步骤,可以选择不同的对照对流程进行监控(图 1)。
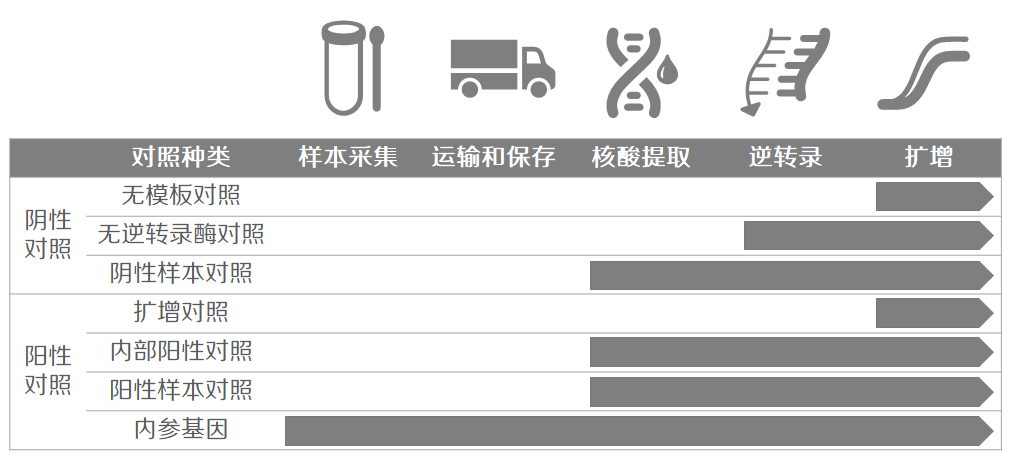 图 1. 实验流程和常见阴阳性对照种类。
图 1. 实验流程和常见阴阳性对照种类。
阴性对照
荧光定量 PCR 的灵敏度可以达到 1 拷贝/孔,如此高灵敏度的检测手段对实验过程中的污染也非常敏感,我们也无法从单一孔中的扩增曲线来判断是否来源于污染还是来源于真实样本的扩增。这时,就需要阴性对照来监控和发现污染的发生。常用的阴性对照包括以下几种:
无模板对照
No Template Control, NTC
使用水代替定量 PCR 反应中的核酸,其它试剂照常加入,用于监控扩增反应体系中的污染。正常情况下,NTC 孔不会有扩增;当 NTC 出现扩增,则预示体系中有污染。在 SYBR Green 实验中,NTC 出现扩增也可能是来源于引物二聚体的形成,此时则需要通过优化引物的设计来减少引物二聚体对结果的影响。
无逆转录酶对照
No Reverse-Transcriptase Control, No RT
当进行 RNA 定量实验时,如果引物和探针设计在同一个外显子上,就无法从结果中判断扩增是否来源于未去除干净的 DNA,从而影响定量结果的准确性。除了在引物和探针设计上面下功夫,还可以设置无逆转录酶对照。即在逆转录实验时,不加逆转录酶,并进行后续的定量 PCR 检测。无逆转录对照中由于没有 cDNA,DNA 聚合酶无法扩增 mRNA,则不应发生扩增。如果检测到扩增,则样本中可能含有未去除干净的 DNA。
阴性样本对照
Negative Sample Control
阴性样本指不含有目的基因或者靶序列的样本,也可以是样本保存液。从核酸提取开始做起,经历提取、逆转录(如有)和扩增过程。如果出现扩增,则说明其中某一实验步骤中存在污染,结合 NTC 结果,可以判断是否是样本提取过程中引入的污染。
阳性对照
荧光定量 PCR 实验从样本采集到最后的结果分析分为几个步骤完成,任何一个环节出现问题,都会对结果产生影响。当出现一个无扩增或者 Ct 值偏大的样本孔,到底是真的没有要检测的对象,还是扩增有问题,亦或是提取中的问题?为了发现这种假阴性的发生,合理的阳性对照可以监控实验的不同步骤:
扩增对照
Amplification Control
可使用含有扩增片段的质粒、假病毒或者基因组 DNA/cDNA 作为扩增阳性对照,监控荧光定量 PCR 的体系是否正常,包括酶、引物、探针等。如果检测中包含多个目标片段,可以将这些目标片段都克隆到同一个质粒中,方便制备和使用。当扩增对照没有扩增,或者 Ct 值大于预期,则说明定量 PCR 体系存在问题。
内部阳性对照
Internal Positive Control, IPC
如果想监控每一份样本从核酸提取到逆转录以及最后的荧光定量 PCR 的过程,可以在提取之前在每个样本中加入一段外源 DNA 或 RNA(不含目的片段)(表 1),并在定量 PCR 时进行单管多重 PCR,同时检测目的基因和这段序列。在每个样本中加入特定拷贝数的 IPC,进而从该段序列的 Ct 值判断对应样品孔中的核酸富集和扩增效率。也可以选择的逆转录或者扩增的时候加入到每一个样本孔中,单独监测纯化后的核酸中是否含有逆转录/扩增抑制剂(图 2)。
 表 1:阳性内对照和相关试剂盒
表 1:阳性内对照和相关试剂盒
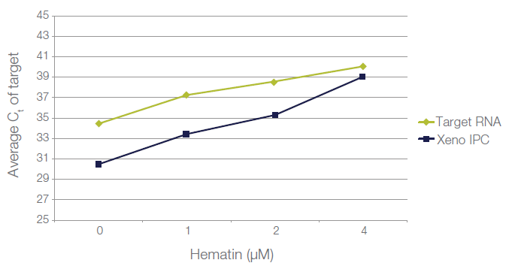 图 2:通过 IPC 提示体系中抑制剂的存在。实验结果为同样浓度的 RNA 加入相同拷贝 Xeno IPC,在不同浓度的扩增抑制剂血红素存在下(0-4μM),Xeno IPC 的 Ct 值与目标 RNA 的 Ct 值定量结果。
图 2:通过 IPC 提示体系中抑制剂的存在。实验结果为同样浓度的 RNA 加入相同拷贝 Xeno IPC,在不同浓度的扩增抑制剂血红素存在下(0-4μM),Xeno IPC 的 Ct 值与目标 RNA 的 Ct 值定量结果。
阳性样本对照
Positive Sample Control
阳性内对照虽然可以在一定程度上反应核酸提取效率,但是却很难反馈提取流程中对核酸释放的效率。一些病原体的样本,尤其是含有革兰氏阳性菌或者真菌样本,充分的酶消化或者机械裂解对于最终检测的灵敏度有显著影响。为了能更好的反映提取效率,可以选择已知阳性的样本或者保存在相似基质中已知浓度的病原体,作为单独的样本进行提取和后续的 RT-PCR,通过 Ct 值评断实验流程。
内参基因
Endogenous Control
上面提到的阳性对照能够为实验流程提供很多质控信息。对于样本本身的质量,比如拭子是否刮取到样本、RNA 在运输和保存过程中是否有严重的降解等问题,则可以通过对内参基因的定量来帮助回答。
内参基因一般选择在取样组织或细胞中均有足量表达的基因,且其表达量不受环境、实验处理条件和取样时间等因素影响, 如管家基因(housekeeping gene)。常用人类内参基因如表 2 所示。要注意没有某个内参基因是万能的,需要根据样本类型和实验处理方式进行评估和选择(可参考 Application Note: Using TaqMan Endogenous Control Assays to select an endogenous control)。实验中通过内参基因的 Ct 值来判断取样和样本降解情况。在相对定量实验中,内参基因亦可用于对取样量进行均一化。
如果进行的是单管多重实验,还需考虑内参基因的表达量。当内参基因表达量远高于目的基因时,内参基因将优势扩增,体系中的原料消耗速度过快,造成目的基因扩增效率降低。此时可以选择引物浓度降低的 TaqMan 试剂盒(Primer-Limited)对内参基因进行测定。
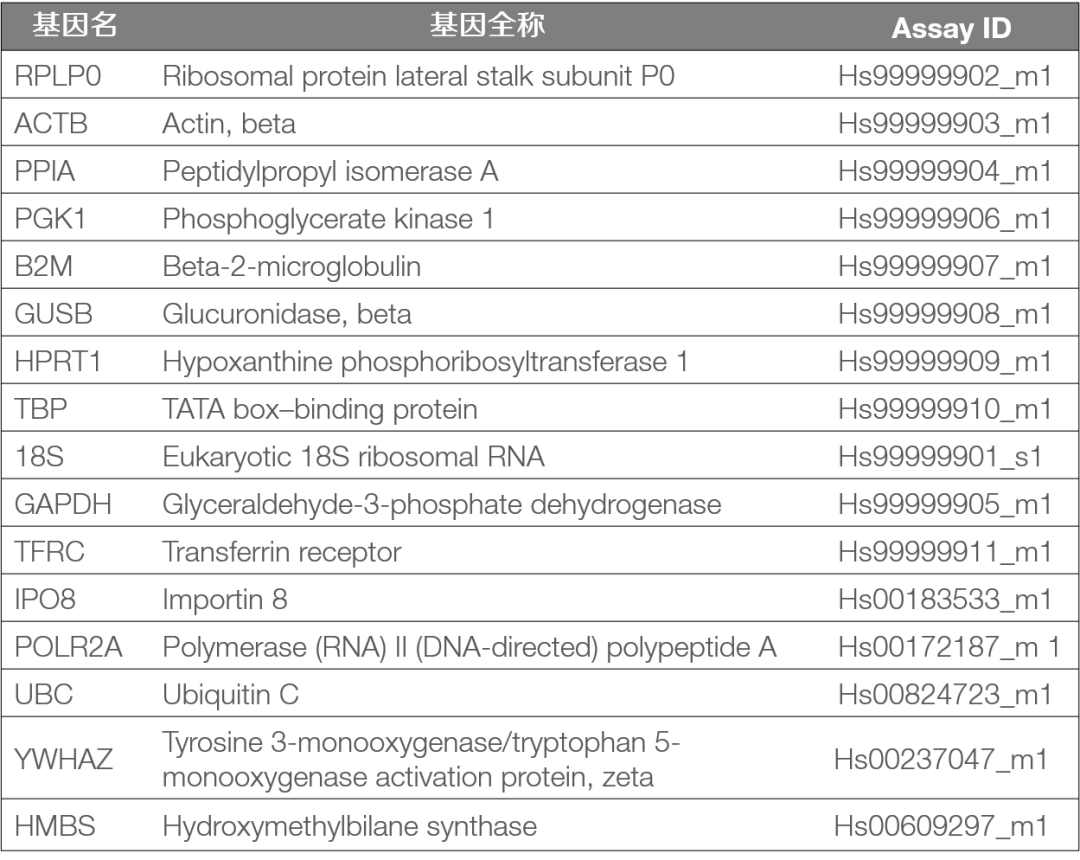 表 2:常用人类内参基因试剂盒(cDNA)
表 2:常用人类内参基因试剂盒(cDNA)
如何避免污染发生?出现污染怎么办?
样本间的交叉污染
为了避免样本之间的交叉污染,规范化的取样和样本保存非常重要。不同样本移液时谨记更换枪头,并尽量使用带滤芯的枪头;不同样本尽量避免同时开盖或剧烈震荡样本,也要避免反复吹吸导至的气溶胶形成和扩散。一旦发生样本溢出,应马上进行清污,降低对后续实验造成的影响。
实验室设备的污染
对于核酸提取仪、实验台面、超净台等可在实验结束后用 70% 的乙醇或者 10% 的次氯酸钠(具腐蚀性,建议使用前咨询设备供应商)擦拭或者利用紫外线照射 5-20 分钟进行表面清洁。如果需要对残留的核酸进行更彻底的清洁, DNAZap™ PCR DNA Degradation Solutions 能更有针对性地降解仪器和台面上残留的 DNA 和 RNA。
试剂组分的污染
按照标准 PCR 实验室的分区要求,在清洁度最高的「试剂储存和准备区」进行试剂的制备、分装和预混液的制备。大包装的 qPCR 试剂开封后进行分装,以减少反复冻融和吸取次数。在做多样本 PCR 反应时,先配制反应混合液分装至反应管中,最后加入样本核酸。避免同时开盖,实现完全闭管操作。实验试剂应与样品和 PCR 产物分开保存,不应放于同处。
前次 PCR 扩增产物和引物残余污染
标准的 PCR 实验室分区通过「标本制备区」和「扩增区」分割开 PCR 体系配置和 PCR 扩增实验。如果不具备这样的条件,首先要避免荧光定量 PCR 实验结束之后开盖,以防扩增产物形成气溶胶对后续实验造成污染。少量意外开盖不能避免时,可以使用含有 UNG 酶(uracil-N-glycoslyase, 尿嘧啶 DNA 糖基化酶)的扩增预混液。如果在 PCR 反应中以 dUTP 代替 dTTP 参入到 PCR 产物中,形成了含有 dUTP 的扩增产物,UNG 酶能选择性断裂单链和双链 DNA 中 U 碱基的糖苷键, 降解 PCR 扩增产物,对于热敏感性的 UNG 酶,50℃ 温度即可失活,不影响本次扩增片段。
通过以上介绍,相信大家已经对不同的对照种类和用途有了足够的了解,在实践中还需要针对具体需求进行选择。合理的对照能让我们及时发现荧光定量 PCR 实验中的问题,而规范的操作流程和良好的实验习惯才能在根源上避免这些问题的发生。双剑合并才能放心地收获实验结果。
参考文献:
Nolan, T., Huggett, J.F. and Sanchez, E., 2013. Good practice guide for the application of quantitative PCR (qPCR). Teddington: LGC.