读一文掌握LncRNA研究套路
互联网
近年来lncRNA的研究进展迅猛,各类 lncRNA 被大量发现,lncRNA的研究将是 RNA 基因组研究领域非常热门的一个方向。小编也正好也在做lncRNA相关的课题,今天就总结一下lncRNA的研究套路和最新研究进展。
• LncRNA基本介绍
LncRNA:long non-coding RNAs是一类长度大于200nt,但不编码蛋白质的RNAs,广泛存在于动植物中。它们曾长期被误认为是遗传暗物质,但近些年研究证实这类RNAs在生物的生命活动过程中起着重要的调控作用。
特点
1. 长度在200-100,000nt
2. 没有编码蛋白质潜能
3. 具有细胞或组织类型特异性
4. 表达量和保守性比mRNA低
5. 部分lncRNA不含有polyA尾巴
6. 部分也会翻译小肽段
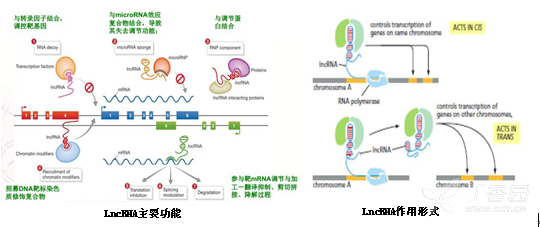
• LncRNA功能及作用形式
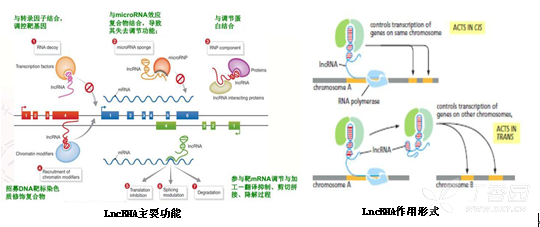
功能
1. 结合转录因子,干扰其靶基因,从而调控转录
2. 作为分子海绵,吸附miRNA
3. 与调节蛋白结合,影响蛋白多聚物的形成
4. 招募染色质修饰因子,改变染色质的修饰水平
5. 与mRNA配对结合,影响翻译,剪切,mRNA的稳定性(类似miRNA功能)
作用
1. Co-location,也称cis作用
2. Co-expression, 也称trans作用
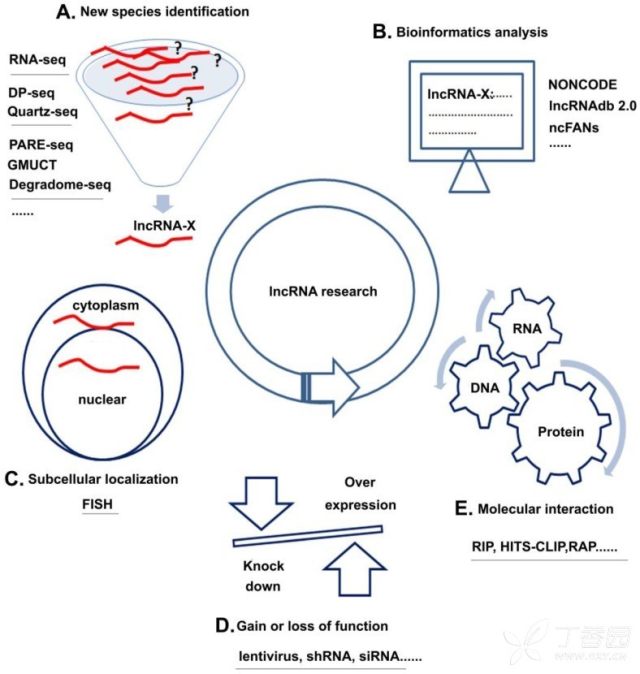
• LncRNA研究基本技术
1. 芯片或测序寻找新的lncRNA
2. 生物信息学分析
3. lncRNA定位
4. 过表达或敲减功能验证
5. lncRNA互作机制研究
• LncRNA的生物信息学分析
1. 基本处理
Ø rRNA比例评估
Ø 基本比对统计,链特异数据评估
Ø Cufflink,stringtie转录本组装
2. 特性分析
Ø 序列,位点保守性分析
Ø 外显子个数,表达和长度分析
Ø 定量差异分析
3. 新LncRNA鉴定
Ø 与已知lncRNA库比对过滤
Ø 过滤exon<2,长度<200bp,FPKM<1转录本
Ø CPC,CNCI,phyloCSF编码潜能预测
Ø ORF长度过滤
Ø miRNA前体序列过滤
4. 功能分析
Ø 顺和反式靶基因预测
Ø 靶基因功能富集分析
Ø 共表达网络分析
• LncRNA表达验证
1. qRT-PCR验证
Ø cDNA质量一定要高,保证没有基因组DNA的污染
Ø 按变化倍数排序,优先选择差异变化明显的lncRNA
Ø 按FPKM或reads count排序,优先选择表达量高的lncRNA
2. Northern Blot
Ø 既可以验证lncRNA的表达丰度又可以验证序列信息,但精度不如qRT-PCR

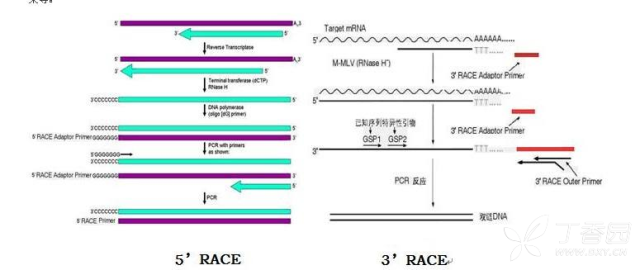
3. cDNA末端快速扩增(RACE)
Ø 确定lncRNA 5’和3’末端序列,进而获得lncRNA的全长信息
• LncRNA定位验证
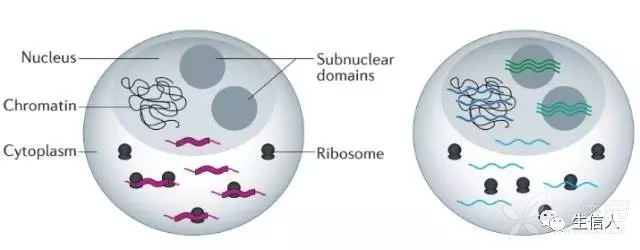
1. FISH(Fluorescence in Situ Hybridization)验证其亚细胞定位,因为其亚细胞定位与lncRNA的调控机制和功能相关。
2. 对于已知lncRNA可以通过RNALocate数据库检索其亚细胞定位。
• LncRNA功能验证
1. 功能获得
构建lncRNA过表达载体,观察过表达lncRNA后对细胞增殖、凋亡、侵袭等影响。
2. 功能缺失
根据其亚细胞定位选择合适的敲减方法。有时发现细胞的感染效率很高,但是lncRNA的干扰效率却很低。因为RNA干扰作用只作用在胞浆内,细胞核中的lncRNA无法起作用,这时一般的siRNA或者shRNA方法可能不适用。
3. 其他敲减方法:CRISPR/Cas9、反义寡核苷酸、位点反转和启动子缺失等方法。

• 非编码能力验证
构建含有肽段和lncRNA的质粒,验证其是否有编码能力。

• LncRNA互作验证
1.RIP (蛋白已知,RNA未知)
RIP(RNA immunoprecipitation)又称为RNA结合蛋白免疫沉淀技术,相当于RNA的ChIP实验(染色质免疫沉淀)。
目的:RIP是研究RNA与蛋白相互作用的重要手段,利用RIP可以证明蛋白是否与lncRNA发生相互作用。
原理:利用目的蛋白结合RNA形成沉淀复合物,从沉淀的RNA蛋白复合物中纯化RNA,再进行定量或测序检测。

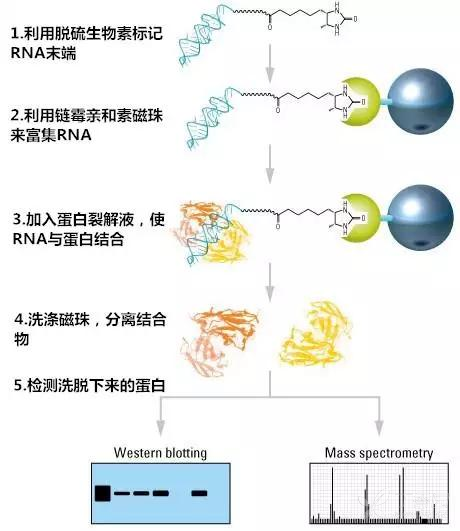
2.RNA-pull down (RNA已知,蛋白未知)
目的:RNA pull-down实验主要用来寻找与目的lncRNA结合的蛋白。
原理:蛋白与生物素标记的RNA孵育结合,富集的蛋白通过SDS-PAGE分离,最后选择特异性蛋白条带进行质谱鉴定。
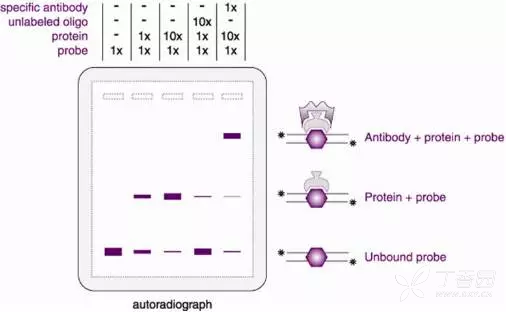
3. EMSA(RNA已知,蛋白已知)
目的: RNA EMSA是通过凝胶电泳迁移检测蛋白-RNA互作的一种技术。
原理:标记的RNA探针和蛋白孵育,当蛋白-RNA复合体形成后,利用非变性聚丙烯酰胺凝胶分离,来确定RNA结合蛋白的特异性。
• LncRNA研究最新案例和进展
1. 案例-肿瘤
期刊: Nat Cell Biol (IF=20.06)
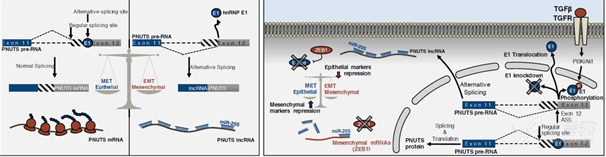
Grelet et al. A regulated PNUTS mRNA to lncRNA splice switch mediates EMT and tumour. Nat Cell Biol. 2017 Sep;19(9):1105-1115.
LncRNA对肿瘤进展的贡献以及驱动其表达的调控机制是热点研究领域。PNUTS基因的pre-RNA在不同条件下能剪切成两种产物:lncRNA-PNUTS和正常mRNA-PNUTS,两种分子在肿瘤中发挥着不同作用,此研究详细的揭示其产生的剪切机制及两种分子的功能机制。
点评:实验机制王道文章
2. 案例-CRISPR-Cas9
期刊:Nature (IF=40.137)

Joung et al. Genome-scale activation screen identifies a lncRNA locus regulating a gene neighbourhood. Nature. 2017 Aug 17;548(7667):343-346
哺乳动物基因组包含数万个长链非编码RNA的基因座,其中一些已被发现在生命过程中发挥重要作用。但确定这些lncRNA的功能和机制仍具有挑战性。作者开发了基于全基因组规模的CRISPR-Cas9激活筛选系统,可以靶向超过10,000个lncRNA转录起始位点,用于识别影响感兴趣表型的lncRNA 。通过此技术发现有11个lncRNAs在募集活化因子后介导人类黑素瘤细胞BRAF抑制剂的抗性。
点评:从组学高通量筛选到功能高通量筛选的标杆文章
3. 案例-单细胞核测序
期刊:Nat Commun (IF=12.124)
See K, et al. Single cardiomyocyte nuclear transcriptomes reveal a lincRNA-regulated de-differentiation and cell cycle stress-response in vivo. Nat Commun. 2017 Aug 9;8(1):225
此研究通过对来自小鼠和人衰竭的心肌细胞以及正常的成年心脏的单细胞核RNA测序,发现了心肌细胞亚群上调细胞周期激活等因子并且证明了抑制因子是由体内应激反应所引起的。通过加权基因共表达网络分析来表征这些亚组,并发现一些起关键调节因子的lncRNA。


![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)


![5-溴-4-氯-3-吲哚基β-D-葡萄糖苷酸钠盐[用于生物学研究],129541-41-9,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/874/0460612821870833081.jpg!wh200)