CTAB法提取植物总DNA
互联网
7281
实验概要
CTAB法是一种快速简便的提取植物总DNA的方法,通过实验掌握CTAB法从植物叶片提取DNA的原理和方法。
CTAB法是一种快速简便的提取植物总DNA的方法,通过实验掌握CTAB法从植物叶片提取DNA的原理和方法。
实验原理
CTAB (hexadecyltrimethylammonium bromide,十六烷基三甲基溴化铵),是一种阳离子去污剂,具有从低离子强度溶液中沉淀核酸与酸性多聚糖的特性。在高离子强度的溶液中(>0.7mol/L NaCl),CTAB与蛋白质和多聚糖形成复合物,只是不能沉淀核酸.通过有机溶剂抽提,去除蛋白、多糖、酚类等杂质后加入乙醇沉淀即可使核酸分离出来。采用机械破碎植物细胞,然后加入CTAB分离缓冲液将DNA溶解出来,再经氯仿-异戊醇抽提除去蛋白质,最后得到DNA。
CTAB (hexadecyltrimethylammonium bromide,十六烷基三甲基溴化铵),是一种阳离子去污剂,具有从低离子强度溶液中沉淀核酸与酸性多聚糖的特性。在高离子强度的溶液中(>0.7mol/L NaCl),CTAB与蛋白质和多聚糖形成复合物,只是不能沉淀核酸.通过有机溶剂抽提,去除蛋白、多糖、酚类等杂质后加入乙醇沉淀即可使核酸分离出来。采用机械破碎植物细胞,然后加入CTAB分离缓冲液将DNA溶解出来,再经氯仿-异戊醇抽提除去蛋白质,最后得到DNA。
主要
试剂
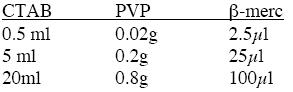
2×CTAB提取缓冲液 [ 详细信息:100mmol/L Tris-HCl(pH 8.0),20mmol/L EDTA, 1.4mol/L NaCl, 2%(w/v)CTAB,40mmol/L 巯基乙醇(随用随加) ]
TE 缓冲液 [ 详细信息:10mmol/L Tris-HCL (pH7.4),1mmol/L EDTA ]
氯仿-异戊醇(24 :1)
70% 乙醇
液氮
2×CTAB提取缓冲液 [ 详细信息:100mmol/L Tris-HCl(pH 8.0),20mmol/L EDTA, 1.4mol/L NaCl, 2%(w/v)CTAB,40mmol/L 巯基乙醇(随用随加) ]
TE 缓冲液 [ 详细信息:10mmol/L Tris-HCL (pH7.4),1mmol/L EDTA ]
氯仿-异戊醇(24 :1)
70% 乙醇
液氮
主要设备
冷冻高速离心机
台式高速离心机
移液器
水浴锅
陶瓷研钵
离心管 [ 详细信息:50ml,有盖 ]
离心管 [ 详细信息:5ml和1.5ml ]
小玻棒 [ 详细信息:形状为弯成钩状的 ]
冷冻高速离心机
台式高速离心机
移液器
水浴锅
陶瓷研钵
离心管 [ 详细信息:50ml,有盖 ]
离心管 [ 详细信息:5ml和1.5ml ]
小玻棒 [ 详细信息:形状为弯成钩状的 ]
实验步骤
1. 取1-50g新鲜植物材料,于液氮中研成粉。
2. 将冻粉转入预冷的 离心管 中,立即加入等体积(w/v) 2×CTAB提取缓冲液,65℃保温10-20分钟,其间不时摇动。
3. 加入等体积的氯仿/异戊醇,轻缓颠倒 离心管 混匀,室温下,12000r/min 离心10-20分钟。
4. 将上清液转入另一离心管中,加入等体积的氯仿/异戊醇,颠倒离心管混匀,室温、12000r/min 离心10分钟。
5. 将上层水相转入新的经硅烷化处理的离心管中,加入0.6-1倍体积的异丙醇,混匀,室温下放置30分钟。
6. 3500-4000r/min 离心5-10分钟,去上清液, 70%乙醇漂洗,沉淀吹干。
7. 风干后加入40ul的TE 缓冲液 溶解DNA,-20℃保存备用。。
8. 取2ul溶液电泳检测。
1. 取1-50g新鲜植物材料,于液氮中研成粉。
2. 将冻粉转入预冷的 离心管 中,立即加入等体积(w/v) 2×CTAB提取缓冲液,65℃保温10-20分钟,其间不时摇动。
3. 加入等体积的氯仿/异戊醇,轻缓颠倒 离心管 混匀,室温下,12000r/min 离心10-20分钟。
4. 将上清液转入另一离心管中,加入等体积的氯仿/异戊醇,颠倒离心管混匀,室温、12000r/min 离心10分钟。
5. 将上层水相转入新的经硅烷化处理的离心管中,加入0.6-1倍体积的异丙醇,混匀,室温下放置30分钟。
6. 3500-4000r/min 离心5-10分钟,去上清液, 70%乙醇漂洗,沉淀吹干。
7. 风干后加入40ul的TE 缓冲液 溶解DNA,-20℃保存备用。。
8. 取2ul溶液电泳检测。
注意事项
所有操作均须温和,避免剧烈震荡。
所有操作均须温和,避免剧烈震荡。