凝胶迁移滞留试验法
互联网
3474
凝胶迁移滞留试验法
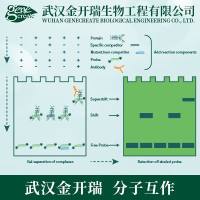
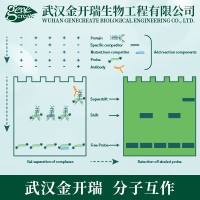
EMSA是近年发展起来的研究核酸与蛋白质 相互作用简单、快速、敏感的方法,目前已经成为转录因子研究的经典方法。其基本原理是蛋白质可以与末端标记的核酸探针结合,电泳时这种复合物比无蛋白质结合的探针在凝胶中泳动的速度慢,即表现为相对滞后。该方法可用于检测DNA结合蛋白、RNA结合蛋白,并可通过加入特异性的抗体来检测特定的蛋白质,并可进行未知蛋白的鉴定。
EMSA基本原理示意图
核转录因子是一类与某些基因启动子或增强子序列相结合而启动基因转录的蛋白质,其检测的方法包括免疫组织化学、蛋白质印迹及EMSA。免疫组织化学与蛋白质印迹虽然操作相对简单,无放射性损伤,但特异性不强,不能反映核蛋白在核内的DNA结合活性,而某些核蛋白的抗体价格相当昂贵,限制了其应用。因此,目前检测核转录因子活力最常用的方法仍为EMSA。该技术是将放射性同位素标记的DNA探针与核抽提物一起孵育,在非变性条件下直接电泳。由于探针结合了核蛋白,使其相对分子质量和电荷发生了改变,因而导致聚丙烯酰胺凝胶电泳时其电泳迁移率发生改变。结合带通常较游离探针泳动率慢得多,形成滞后的电泳条带。其放射自显影的密度及面积即可反映活化易位至核内的核蛋白量。应用凝胶图像分析系统进行密度扫描,以扫描值作为核蛋白的活性水平。该法不仅简单迅速,而且灵敏度高,而它的另一特点是可以利用竞争性抑制试验来评价蛋白与DNA结合的特异性。但是EMSA操作相当复杂,整个过程包括丁核蛋白的抽提、定量,探针的标记与纯化,探针与蛋白质的结合,电泳与显影等。一般认为,EMSA成败的关键在于探针的标记,标记探针的放射性强度最好>15X10;Bq~1。应用磷屏曝光的灵敏度相当高,所以探针的放射性强度不必达到上述标准。而且,磷屏的优点是可以一次性曝光8―10张胶片。这样,可以使得同一个实验的不同组具有可比性,减少了操作所造成的偏倚。另外,又可简化实验过程,节省时间。