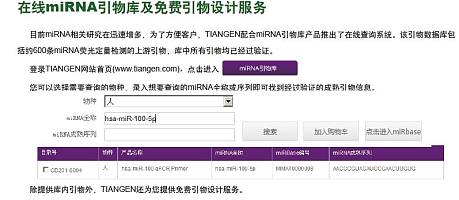
【共享】很不错的MIRNA检测实验流程
丁香园论坛
3303
一.实验材料及其仪器
1.实验仪器
iQ5 Real Time PCR Detection System: Bio-Rad
2.实验材料及试剂
All-in-OneTM miRNA Q-PCR Detection Kit: GeneCopoeia (Cat. No. R0101S )
验证模板:人源十个不同的组织所制备的cDNA
测试引物:共5 对(具体引物序列等详细信息附在产品说明书处,此处略)
Catalog# Primer ID Mature_Acc Mature_ID PCR SIZE
1 miRQP0227 hsmq-0031 MIMAT0000069 hsa-miR-16 75bp GeneCopoeia
2 miRQP0074 hsmq-0032 MIMAT0000422 hsa-miR-124 73bp GeneCopoeia
3 miRQP0096 hsmq-0034 MIMAT0000423 hsa-miR-125b 75bp GeneCopoeia
4 miRQP0175 hsmq-0035 MIMAT0000429 hsa-miR-137 76bp GeneCopoeia
5 miRQP9901 hsnRNA-U6 M14486 hsnRNA-U6 79bp GeneCopoeia
二:验证流程及其条件
RNA 抽提
1. 样品处理
取一定量的十个不同的人源组织标本至冷冻的研钵中,加入液氮研磨至细粉,最
后转移至有1ml TRIzol 的离心管中,反复振荡约5min。(如为细胞样品,则取约
106~107 左右的细胞数至1ml TRIzol 中,反复吹打至裂解。)
2. 相分离
室温放置10min 左右后,每1ml TRIzol 中加入氯仿为200μl,盖上盖子,剧烈振
荡约1min,室温静置2~5min,然后12000g 冷冻离心15min(6℃),小心取出样品,
通过观察可以发现样品分三层,其中最上层含有RNA 样品。
3. RNA 沉淀
小心吸取上清液约450μl(每1ml TRIzol 的吸取量)至含有600μl 冷冻异丙醇的新
离心管中,混匀,-20℃放置约10min,12000g 冷冻离心10min(6℃)。
4. RNA 洗涤
去上清,加入500μl 冷冻的75%乙醇,弹起沉淀后 12000g 冷冻离心5min(6℃),
去上清,再稍离,吸去上清液。
5. RNA 溶解
风干约5~10min(注意不能风太干,只需要沉淀泛白即可),加入DEPC 水约30μl。
贴上标签后-80℃保存。
6.RNA 浓度测定
吸取1μl 抽提的RNA 用DEPC 水稀释10 倍后,在Nanodrop 上测定RNA 浓度,
以DEPC 水做空白对照,同时记录RNA 浓度及其OD260/OD280。
7.RNA 电泳检测
7.1.变性胶制备
取1g Agarose + 75ml 去离子水煮沸,冷却至70℃左右加入10ml 10×Mops 和15ml
甲醛及EB。倒胶至宽口梳子的胶板上,盖上盖子。
7.2.电泳缓冲液配制(1×Mops)
取50ml 10×Mops ,用去离子水稀释至500ml,倒入电泳槽中,再在电泳缓冲液中
添加EB.
7.3.RNA 样品处理
取RNA 样品3μl,补充DEPC 水至18μl,65℃变性10min 后立即冷却,加入2μl
10×RNA loading buffer 即可电泳
7.4.RNA 电泳
先把RNA 胶放入电泳槽中,100V 作用电泳约5min,再在点样孔中点入处理过的
RNA 样品,100V 左右电泳至溴酚蓝至胶的1/3 处,取胶拍照。
8.RNA 检测结果
8.1. 十个不同组织的RNA 电泳图(取各3μl RNA 样品):
8.2 RNA 电泳的各泳道所对应的样品及其样品浓度和OD260/OD280
泳道 组织 Conc.(ng/μl) OD260/OD280
1 脑 2385 1.9
2 肺 2430 1.94
3 肝 2521 1.91
4 肾 6444 1.94
5 乳腺 2785 1.87
6 睾丸 2972 1.9
7 胎盘 3515 1.91
8 脾 3344 1.91
9 心脏 3394 1.91
10 胰腺 3101 1.91
注:抽提的RNA 必须含有小分子RNA 才能进行miRNA 的检测,所以所选的试剂盒必须为总RNA
抽提试剂盒或小分子RNA 抽提试剂盒; 同时RNA 抽提的质量是进行下游实验的关键,敬请严
格按照所使用的RNA 抽提试剂盒要求进行抽提,抽提结束后,敬请电泳检测RNA 抽提质量。
miRNA 反转录反应
a. 融解miRNA 反转录所需的试剂,上下轻微颠倒混匀,短暂离心后放置冰上待用。
b. miRNA 反转录反应液的配制
在冰上的预冷RNase free 的反应管内加入以下试剂至总体积25μl
试剂组分 体积 终浓度
Total RNA 2μg
2.5U/μl PolyA Polymerase 2.5U
RTase Mix
5×Reaction Buffe
ddH2O(RNase/DNase free) 补至25μl
※ 在反应中使用的total RNA 必须含有小分子RNA。
※ Total RNA 使用量可在1ng~5μg 之间调整, 如使用纯化的小分子RNA,其使用量可在0.1ng~
1μg 之间调整。
c. 反转录反应
混匀配制的反应mix,短暂离心后在37℃反应60min,结束后再进行85℃ 5min 灭
活处理。所得的反转录产物可用灭菌水稀释5 倍进行下游qPCR 实验。
Q-PCR 检测miRNA
1. 融解All-in-OneTM miRNA Q-PCR Detection Kit 中的2×All-in-OneTM Q-PCR mix 上下轻
微颠倒混匀,短暂离心后放置冰上待用。
2. 冰上进行Q-PCR 反应液的配制(所有miRNA 进行复孔测试,同时进行单孔NTC(No
template control)测试)
试剂组分 体积 终浓度
2×All-in-OneTM Q-PCR Mix 10ul 1×
All-in-OneTM miRNA Q-PCR Primer(2μM)2ul 0.2uM
Universal Adaptor PCR Primer (2μM)2ul 0.2uM
1st strand cDNA(5 倍稀释液) 2ul
ddH2O 4ul
Final Volume 20μL
注:在实验中设计了NTC(No Template Control),其为阴性对照,即用水来代替模板cDNA,其
它试剂不变,从而来质控是否体系有污染;实验中如需更改反应体积,敬请保持最适条件下各
组分的比例;试剂盒中的Rox Reference Dye 使用在需用Rox 校正的仪器,如ABI 的定量PCR
仪
3. 充分混匀Q-PCR 反应液,添加至PCR 反应管中,短暂离心,确保所有试剂到反应管
底部。
4. Q-PCR 反应,使用标准的三步法进行检测(以Bio-Rad 的iQ5 进行实验的设计)
循环数 步骤 温度 时间 检测
1 预变性 95℃ 10min 否
变性 95℃ 10sec 否
40 退火 60℃ 20sec 否
延伸 72℃ 10sec 是
反应结束后,立即进行融解曲线分析
检测温度范围 升温速率 恒温时间 检测
66℃~95℃ 0.5℃/次 6 sec/次
30℃ 30sec
注: 以上的反应条件主要参考的为Bio-Rad 的iQ5 定量PCR 仪器,如使用的为不同公司的定量
PCR 仪,请按照不同的仪器要求,调整延伸时间及其融解曲线分析的条件;各miRNA 的退
火问题可能例有差别,具体请参考测试结果部分。
三:测试结果
1. hsa-miR-16(hsmq-0031 引物)
推荐退火问题:60℃
hsa-miR-16 扩增曲线示意图 hsa-miR-16 融解曲线示意图
2.hsa-miR-124(hsmq-0032 引物)
推荐退火温度:60℃
hsa-miR-124 扩增曲线示意图 hsa-miR-124 融解曲线示意图
3.hsa-miR-125b(hsmq-0034 引物)
推荐退火温度:60℃
hsa-miR-125b 扩增曲线示意图 hsa-miR-125b 融解曲线示意图
4.hsa-miR-137(hsmq-0035 引物)
推荐退火温度:60℃
hsa-miR-137 扩增曲线示意图 hsa-miR-137 融解曲线示意图
5.hsnRNA U6 引物测试
推荐退火温度:60℃
hsnRNA U6 扩增曲线示意图 hsnRNA U6 融解曲线示意图
6. 电泳结果
取5μl PCR 产物进行电泳,胶浓度(3%),所有检测都为两个阳性,一个NTC
其中泳道1 为hsa-miR-16、泳道2 为hsa-miR-124、泳道3 为hsa-miR-125b、泳道4 为
hsa-miR-137、泳道5 为hsnRNA-U6
Real
1.实验仪器
iQ5 Real Time PCR Detection System: Bio-Rad
2.实验材料及试剂
All-in-OneTM miRNA Q-PCR Detection Kit: GeneCopoeia (Cat. No. R0101S )
验证模板:人源十个不同的组织所制备的cDNA
测试引物:共5 对(具体引物序列等详细信息附在产品说明书处,此处略)
Catalog# Primer ID Mature_Acc Mature_ID PCR SIZE
1 miRQP0227 hsmq-0031 MIMAT0000069 hsa-miR-16 75bp GeneCopoeia
2 miRQP0074 hsmq-0032 MIMAT0000422 hsa-miR-124 73bp GeneCopoeia
3 miRQP0096 hsmq-0034 MIMAT0000423 hsa-miR-125b 75bp GeneCopoeia
4 miRQP0175 hsmq-0035 MIMAT0000429 hsa-miR-137 76bp GeneCopoeia
5 miRQP9901 hsnRNA-U6 M14486 hsnRNA-U6 79bp GeneCopoeia
二:验证流程及其条件
RNA 抽提
1. 样品处理
取一定量的十个不同的人源组织标本至冷冻的研钵中,加入液氮研磨至细粉,最
后转移至有1ml TRIzol 的离心管中,反复振荡约5min。(如为细胞样品,则取约
106~107 左右的细胞数至1ml TRIzol 中,反复吹打至裂解。)
2. 相分离
室温放置10min 左右后,每1ml TRIzol 中加入氯仿为200μl,盖上盖子,剧烈振
荡约1min,室温静置2~5min,然后12000g 冷冻离心15min(6℃),小心取出样品,
通过观察可以发现样品分三层,其中最上层含有RNA 样品。
3. RNA 沉淀
小心吸取上清液约450μl(每1ml TRIzol 的吸取量)至含有600μl 冷冻异丙醇的新
离心管中,混匀,-20℃放置约10min,12000g 冷冻离心10min(6℃)。
4. RNA 洗涤
去上清,加入500μl 冷冻的75%乙醇,弹起沉淀后 12000g 冷冻离心5min(6℃),
去上清,再稍离,吸去上清液。
5. RNA 溶解
风干约5~10min(注意不能风太干,只需要沉淀泛白即可),加入DEPC 水约30μl。
贴上标签后-80℃保存。
6.RNA 浓度测定
吸取1μl 抽提的RNA 用DEPC 水稀释10 倍后,在Nanodrop 上测定RNA 浓度,
以DEPC 水做空白对照,同时记录RNA 浓度及其OD260/OD280。
7.RNA 电泳检测
7.1.变性胶制备
取1g Agarose + 75ml 去离子水煮沸,冷却至70℃左右加入10ml 10×Mops 和15ml
甲醛及EB。倒胶至宽口梳子的胶板上,盖上盖子。
7.2.电泳缓冲液配制(1×Mops)
取50ml 10×Mops ,用去离子水稀释至500ml,倒入电泳槽中,再在电泳缓冲液中
添加EB.
7.3.RNA 样品处理
取RNA 样品3μl,补充DEPC 水至18μl,65℃变性10min 后立即冷却,加入2μl
10×RNA loading buffer 即可电泳
7.4.RNA 电泳
先把RNA 胶放入电泳槽中,100V 作用电泳约5min,再在点样孔中点入处理过的
RNA 样品,100V 左右电泳至溴酚蓝至胶的1/3 处,取胶拍照。
8.RNA 检测结果
8.1. 十个不同组织的RNA 电泳图(取各3μl RNA 样品):
8.2 RNA 电泳的各泳道所对应的样品及其样品浓度和OD260/OD280
泳道 组织 Conc.(ng/μl) OD260/OD280
1 脑 2385 1.9
2 肺 2430 1.94
3 肝 2521 1.91
4 肾 6444 1.94
5 乳腺 2785 1.87
6 睾丸 2972 1.9
7 胎盘 3515 1.91
8 脾 3344 1.91
9 心脏 3394 1.91
10 胰腺 3101 1.91
注:抽提的RNA 必须含有小分子RNA 才能进行miRNA 的检测,所以所选的试剂盒必须为总RNA
抽提试剂盒或小分子RNA 抽提试剂盒; 同时RNA 抽提的质量是进行下游实验的关键,敬请严
格按照所使用的RNA 抽提试剂盒要求进行抽提,抽提结束后,敬请电泳检测RNA 抽提质量。
miRNA 反转录反应
a. 融解miRNA 反转录所需的试剂,上下轻微颠倒混匀,短暂离心后放置冰上待用。
b. miRNA 反转录反应液的配制
在冰上的预冷RNase free 的反应管内加入以下试剂至总体积25μl
试剂组分 体积 终浓度
Total RNA 2μg
2.5U/μl PolyA Polymerase 2.5U
RTase Mix
5×Reaction Buffe
ddH2O(RNase/DNase free) 补至25μl
※ 在反应中使用的total RNA 必须含有小分子RNA。
※ Total RNA 使用量可在1ng~5μg 之间调整, 如使用纯化的小分子RNA,其使用量可在0.1ng~
1μg 之间调整。
c. 反转录反应
混匀配制的反应mix,短暂离心后在37℃反应60min,结束后再进行85℃ 5min 灭
活处理。所得的反转录产物可用灭菌水稀释5 倍进行下游qPCR 实验。
Q-PCR 检测miRNA
1. 融解All-in-OneTM miRNA Q-PCR Detection Kit 中的2×All-in-OneTM Q-PCR mix 上下轻
微颠倒混匀,短暂离心后放置冰上待用。
2. 冰上进行Q-PCR 反应液的配制(所有miRNA 进行复孔测试,同时进行单孔NTC(No
template control)测试)
试剂组分 体积 终浓度
2×All-in-OneTM Q-PCR Mix 10ul 1×
All-in-OneTM miRNA Q-PCR Primer(2μM)2ul 0.2uM
Universal Adaptor PCR Primer (2μM)2ul 0.2uM
1st strand cDNA(5 倍稀释液) 2ul
ddH2O 4ul
Final Volume 20μL
注:在实验中设计了NTC(No Template Control),其为阴性对照,即用水来代替模板cDNA,其
它试剂不变,从而来质控是否体系有污染;实验中如需更改反应体积,敬请保持最适条件下各
组分的比例;试剂盒中的Rox Reference Dye 使用在需用Rox 校正的仪器,如ABI 的定量PCR
仪
3. 充分混匀Q-PCR 反应液,添加至PCR 反应管中,短暂离心,确保所有试剂到反应管
底部。
4. Q-PCR 反应,使用标准的三步法进行检测(以Bio-Rad 的iQ5 进行实验的设计)
循环数 步骤 温度 时间 检测
1 预变性 95℃ 10min 否
变性 95℃ 10sec 否
40 退火 60℃ 20sec 否
延伸 72℃ 10sec 是
反应结束后,立即进行融解曲线分析
检测温度范围 升温速率 恒温时间 检测
66℃~95℃ 0.5℃/次 6 sec/次
30℃ 30sec
注: 以上的反应条件主要参考的为Bio-Rad 的iQ5 定量PCR 仪器,如使用的为不同公司的定量
PCR 仪,请按照不同的仪器要求,调整延伸时间及其融解曲线分析的条件;各miRNA 的退
火问题可能例有差别,具体请参考测试结果部分。
三:测试结果
1. hsa-miR-16(hsmq-0031 引物)
推荐退火问题:60℃
hsa-miR-16 扩增曲线示意图 hsa-miR-16 融解曲线示意图
2.hsa-miR-124(hsmq-0032 引物)
推荐退火温度:60℃
hsa-miR-124 扩增曲线示意图 hsa-miR-124 融解曲线示意图
3.hsa-miR-125b(hsmq-0034 引物)
推荐退火温度:60℃
hsa-miR-125b 扩增曲线示意图 hsa-miR-125b 融解曲线示意图
4.hsa-miR-137(hsmq-0035 引物)
推荐退火温度:60℃
hsa-miR-137 扩增曲线示意图 hsa-miR-137 融解曲线示意图
5.hsnRNA U6 引物测试
推荐退火温度:60℃
hsnRNA U6 扩增曲线示意图 hsnRNA U6 融解曲线示意图
6. 电泳结果
取5μl PCR 产物进行电泳,胶浓度(3%),所有检测都为两个阳性,一个NTC
其中泳道1 为hsa-miR-16、泳道2 为hsa-miR-124、泳道3 为hsa-miR-125b、泳道4 为
hsa-miR-137、泳道5 为hsnRNA-U6
Real