【求助】P53的翻译后修饰都有哪些? 怎样验证其修饰后与靶标启动子的结合活性的变化?
丁香园论坛
3085
P53的翻译后修饰都有哪些?听说有磷酸化和乙酰化。还有其他的吗?
怎样找出P53是发生了哪种修饰变化?
如何设计实验验证P53修饰后,与靶标启动子结合时,有没有产生结合活性的变化啊?
谢谢!
怎样找出P53是发生了哪种修饰变化?
如何设计实验验证P53修饰后,与靶标启动子结合时,有没有产生结合活性的变化啊?
谢谢!
p53的修饰
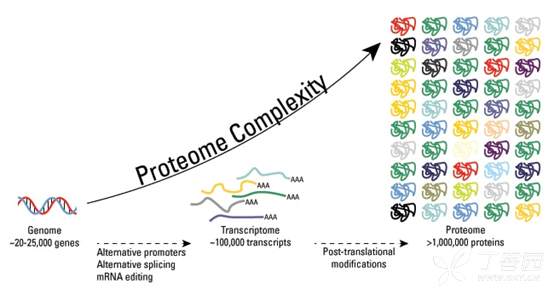
正常细胞在非应激状态下p53的水平和活性都较低,受到应激作用时,p53通过一系列的翻译后修饰被活化,并能结合特异的DNA序列。翻译后修饰是调节蛋白质功能的一个主要机制,p53在多个位点上可被磷酸化、顺-反异构化、乙酰化、泛素化、甲基化、糖基化等修饰,从而显示其生物学重要性。这种显示细胞或组织特异性并依赖细胞周期位置的多重修饰,是一种复杂的调节方式,随着细胞对DNA损伤、增殖、老化等产生的细胞信号的反应而发生波动。
磷酸化修饰
P53的磷酸化在多数情况下与蛋白质的稳定性有关。p53 N-末端的三个位点Ser15、Thr18、Ser20磷酸化后,使p53和其主要的负性调节因子MDM2之间的相互作用消失,而和乙酰转移酶p300的结合增强,从而增加了p53的水平和稳定性。Ser15可在IR(电离辐射)或UV(紫外线)作用下发生磷酸化。同时IR 或UV 还可以分别通过活化CHK2(细胞周期关卡激酶2)和CHK1(细胞周期关卡激酶1)引起Ser20的磷酸化。
除常见的72位密码子多态性外,p53肿瘤还可显示一种少见的47位残基上的单核苷酸多态现象,野生型p53在此残基上编码脯氨酸,而在少数人群中编码的则是丝氨酸。此残基临近的Ser46被p38磷酸化后可以显著增强p53诱导凋亡的能力,而Ser-47多态变异体取代能被脯氨酸激酶直接识别的脯氨酸残基后对p38磷酸化Ser-46所起的作用较弱。与此结论相一致,Ser-47变异体同野生型p53相比诱导凋亡的能力降低了5倍,此变异体转录激活两种p53凋亡靶基因(p53AIP1 ~undefined*3)的能力减弱。p53的47位密码子多态现象在癌症发生、进展、治疗效果中可能起一定作用[19]。
p53 C-末端区域的Ser315、Ser371、Ser376 、Ser378 和Ser392的磷酸化是众所周知的,最近研究显示其他位点也可以发生磷酸化,如Ser313、Ser314、Thr377、Ser378(被CHK1 ,CHK2磷酸化)、Ser366 (只被CHK2磷酸化)、Thr387 (只被CHK1磷酸化)。这些位点的磷酸化可能会改变 Lys373、Lys382乙酰化的方式,但不会改变Lys320,因此可以用来区分P300/CREB结合蛋白(CBP)和P300/CBP 相关因子(PCAF)活性[20].。
当大多数p53的磷酸化可以增强蛋白质的稳定性和活性时,一些位点的磷酸化(Thr55 、Thr155 、Ser205、Ser376)则和p53降解的增加有关。
顺反异构化修饰
p53的活化涉及构象的改变,由肽脯氨酰-顺反异构酶︱(PIN1)引起的特定的脯氨酸残基的顺反异构化可导致构象的改变。PIN1的蛋白结合位点包括一个磷酸化的丝氨酸或苏氨酸及其后紧跟的一个脯氨酸,从而催化脯氨酸残基发生顺反异构化。目前对Ser127-Pro128、Thr150-Pro151基序是否受PIN1的靶向作用还不清楚。PIN1引起的p53构象的改变阻止了MDM2的结合和/或促进了MDM2的解离,从而使p53变得稳定。此外,构象的改变还可能使p300磷酸化p53 C-末端赖氨酸的能力增强,并且可能促进p53核心区域和其特异的启动子相关位点的结合,尤其是与促进凋亡的位点的结合[23]。
乙酰化修饰
乙酰化修饰通过使辅助活化因子聚集,增加p53-DNA的结合,从而促进p53介导的靶基因的转录激活[24]。P300、CBP、PCAF是普遍存在的转录辅助活化剂,它们起组蛋白乙酰基转移酶作用,同时还可以使多种转录因子乙酰化,例如p53。P300/CBP引起的p53的活化可通过p53结合蛋白PRMT1和CARM1(辅助活化因子相关的精氨酸甲基转移酶)相互作用获得。当靶基因的转录激活不再需要p53时去乙酰化作用可以作为一种快速的调节机制来抑制p53的功能。
泛素化修饰
正常细胞中降解是消除p53功能的唯一机制,这种降解部分是由泛素-26S蛋白酶体系统完成的(其它途径是非泛素依赖性的)。泛素是一种高度保守的蛋白质,靶向作用于底物蛋白,使其被26S蛋白酶体降解成多肽。泛素连接酶实现了泛素化修饰的最后一步,这些酶显示出一种高水平的靶向特异性。正常细胞中MDM2是调解p53含量的主要的泛素连接酶,MDM2 结合至p53的N-末端区域,并通过两种机制来抑制p53的活性:一是促进p53输出至胞质并降解;二是阻断p53的转录激活。活化的p53可以上调MDM2,并因此产生了p53-MDM2的自身调节回路。DNA损伤可以导致MDM2稳定性的下降并促进其降解,限制应激反应中p53与MDM2的相互作用,从而保持了p53的活性并减少了其降解 [26]。
甲基化修饰
P53的Lys372残基可以被SET9(SET区域含有的蛋白9)甲基转移酶甲基化修饰,SET9以一种依赖p53甲基化位点的方式调节p53靶基因的表达,从而使甲基化的p53限制在细胞核中,而且甲基化修饰还可以影响其稳定性 [27]。
ADP-核糖基化修饰
ADP-核糖基化修饰是一种可逆的蛋白质的翻译后修饰,涉及许多生物学功能的调节,主要是由多聚腺苷酸聚合酶1(PARP1)催化完成,DNA链断裂时可以使PARP1快速活化,最终引起DNA复制时的多种蛋白质活性的调节、DNA 的修复、检测点的控制等。此外PARP1可能还参与了同源染色体的重组及p53的多聚ADP-核糖化作用[28]
问题1:找出p53相应的修饰变化要通过其相应的抗体来检测,如乙酰化抗体,磷酸化抗体。
问题2:可以转染p53之后,可以通过相应试剂使P53发生相应修饰,然后通过荧光素酶报告载体来检测活性,或者电泳迁移率实验(EMSA)来检测。当然对照要设计好。
正常细胞在非应激状态下p53的水平和活性都较低,受到应激作用时,p53通过一系列的翻译后修饰被活化,并能结合特异的DNA序列。翻译后修饰是调节蛋白质功能的一个主要机制,p53在多个位点上可被磷酸化、顺-反异构化、乙酰化、泛素化、甲基化、糖基化等修饰,从而显示其生物学重要性。这种显示细胞或组织特异性并依赖细胞周期位置的多重修饰,是一种复杂的调节方式,随着细胞对DNA损伤、增殖、老化等产生的细胞信号的反应而发生波动。
磷酸化修饰
P53的磷酸化在多数情况下与蛋白质的稳定性有关。p53 N-末端的三个位点Ser15、Thr18、Ser20磷酸化后,使p53和其主要的负性调节因子MDM2之间的相互作用消失,而和乙酰转移酶p300的结合增强,从而增加了p53的水平和稳定性。Ser15可在IR(电离辐射)或UV(紫外线)作用下发生磷酸化。同时IR 或UV 还可以分别通过活化CHK2(细胞周期关卡激酶2)和CHK1(细胞周期关卡激酶1)引起Ser20的磷酸化。
除常见的72位密码子多态性外,p53肿瘤还可显示一种少见的47位残基上的单核苷酸多态现象,野生型p53在此残基上编码脯氨酸,而在少数人群中编码的则是丝氨酸。此残基临近的Ser46被p38磷酸化后可以显著增强p53诱导凋亡的能力,而Ser-47多态变异体取代能被脯氨酸激酶直接识别的脯氨酸残基后对p38磷酸化Ser-46所起的作用较弱。与此结论相一致,Ser-47变异体同野生型p53相比诱导凋亡的能力降低了5倍,此变异体转录激活两种p53凋亡靶基因(p53AIP1 ~undefined*3)的能力减弱。p53的47位密码子多态现象在癌症发生、进展、治疗效果中可能起一定作用[19]。
p53 C-末端区域的Ser315、Ser371、Ser376 、Ser378 和Ser392的磷酸化是众所周知的,最近研究显示其他位点也可以发生磷酸化,如Ser313、Ser314、Thr377、Ser378(被CHK1 ,CHK2磷酸化)、Ser366 (只被CHK2磷酸化)、Thr387 (只被CHK1磷酸化)。这些位点的磷酸化可能会改变 Lys373、Lys382乙酰化的方式,但不会改变Lys320,因此可以用来区分P300/CREB结合蛋白(CBP)和P300/CBP 相关因子(PCAF)活性[20].。
当大多数p53的磷酸化可以增强蛋白质的稳定性和活性时,一些位点的磷酸化(Thr55 、Thr155 、Ser205、Ser376)则和p53降解的增加有关。
顺反异构化修饰
p53的活化涉及构象的改变,由肽脯氨酰-顺反异构酶︱(PIN1)引起的特定的脯氨酸残基的顺反异构化可导致构象的改变。PIN1的蛋白结合位点包括一个磷酸化的丝氨酸或苏氨酸及其后紧跟的一个脯氨酸,从而催化脯氨酸残基发生顺反异构化。目前对Ser127-Pro128、Thr150-Pro151基序是否受PIN1的靶向作用还不清楚。PIN1引起的p53构象的改变阻止了MDM2的结合和/或促进了MDM2的解离,从而使p53变得稳定。此外,构象的改变还可能使p300磷酸化p53 C-末端赖氨酸的能力增强,并且可能促进p53核心区域和其特异的启动子相关位点的结合,尤其是与促进凋亡的位点的结合[23]。
乙酰化修饰
乙酰化修饰通过使辅助活化因子聚集,增加p53-DNA的结合,从而促进p53介导的靶基因的转录激活[24]。P300、CBP、PCAF是普遍存在的转录辅助活化剂,它们起组蛋白乙酰基转移酶作用,同时还可以使多种转录因子乙酰化,例如p53。P300/CBP引起的p53的活化可通过p53结合蛋白PRMT1和CARM1(辅助活化因子相关的精氨酸甲基转移酶)相互作用获得。当靶基因的转录激活不再需要p53时去乙酰化作用可以作为一种快速的调节机制来抑制p53的功能。
泛素化修饰
正常细胞中降解是消除p53功能的唯一机制,这种降解部分是由泛素-26S蛋白酶体系统完成的(其它途径是非泛素依赖性的)。泛素是一种高度保守的蛋白质,靶向作用于底物蛋白,使其被26S蛋白酶体降解成多肽。泛素连接酶实现了泛素化修饰的最后一步,这些酶显示出一种高水平的靶向特异性。正常细胞中MDM2是调解p53含量的主要的泛素连接酶,MDM2 结合至p53的N-末端区域,并通过两种机制来抑制p53的活性:一是促进p53输出至胞质并降解;二是阻断p53的转录激活。活化的p53可以上调MDM2,并因此产生了p53-MDM2的自身调节回路。DNA损伤可以导致MDM2稳定性的下降并促进其降解,限制应激反应中p53与MDM2的相互作用,从而保持了p53的活性并减少了其降解 [26]。
甲基化修饰
P53的Lys372残基可以被SET9(SET区域含有的蛋白9)甲基转移酶甲基化修饰,SET9以一种依赖p53甲基化位点的方式调节p53靶基因的表达,从而使甲基化的p53限制在细胞核中,而且甲基化修饰还可以影响其稳定性 [27]。
ADP-核糖基化修饰
ADP-核糖基化修饰是一种可逆的蛋白质的翻译后修饰,涉及许多生物学功能的调节,主要是由多聚腺苷酸聚合酶1(PARP1)催化完成,DNA链断裂时可以使PARP1快速活化,最终引起DNA复制时的多种蛋白质活性的调节、DNA 的修复、检测点的控制等。此外PARP1可能还参与了同源染色体的重组及p53的多聚ADP-核糖化作用[28]
问题1:找出p53相应的修饰变化要通过其相应的抗体来检测,如乙酰化抗体,磷酸化抗体。
问题2:可以转染p53之后,可以通过相应试剂使P53发生相应修饰,然后通过荧光素酶报告载体来检测活性,或者电泳迁移率实验(EMSA)来检测。当然对照要设计好。
看看这里,我觉得有你想要的。
http://p53.free.fr/
http://p53.free.fr/
谢谢Burnell同学!
本文由丁香园论坛提供,想了解更多有用的、有意思的前沿资讯以及酷炫的实验方法的你,都可以成为师兄的好伙伴
师兄微信号:shixiongcoming