蛋白质翻译后修饰(PTMs)概述
互联网
2385
蛋白质翻译后修饰 (Protein translational modifications,PTMs) 通过功能基团或蛋白质的共价添加、调节亚基的蛋白水解切割或整个蛋白质的降解来增加蛋白质组的功能多样性。这些修饰包括磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化、脂质化和蛋白水解,几乎影响正常细胞生物学和发病机制的所有方面。因此,识别和理解 PTM 在细胞生物学和疾病治疗和预防的研究中至关重要。
看到一篇 Thermo Fisher的文章,关于翻译后修饰Post-Translational Modifications (PTMs),分享在这儿,原文是英文,值得收藏和学习哦! 文末也有PTMs的一些数据库分享!
文末也有PTMs的一些数据库分享!
 文末也有PTMs的一些数据库分享!
文末也有PTMs的一些数据库分享!Introduction:
在过去的几十年里,科学家们发现人类蛋白质组比人类基因组要复杂得多。虽然估计人类基因组由 20,000 至 25,000 个基因组成,但人类蛋白质组中的蛋白质总数估计超过 100 万个。这些估计证明单基因编码多个蛋白。基因组重组、选择性启动子处的转录起始、差异转录终止和转录本的选择性剪接是由单个基因产生不同 mRNA 转录本的机制。
蛋白质翻译后修饰 (PTMs) 进一步促进了从基因组水平到蛋白质组复杂性的增加。PTMs 是一种化学修饰,在功能蛋白质组中发挥关键作用,因为它们调节活性、定位以及与其他细胞分子(如蛋白质、核酸、脂质和辅助因子)的相互作用。
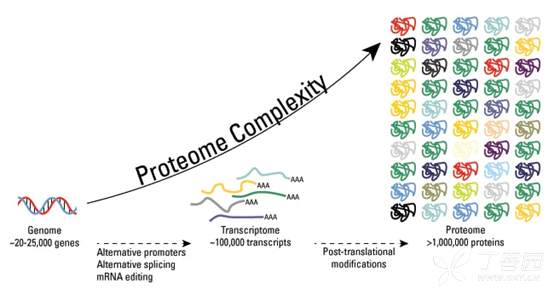
图示:翻译后修饰是增加蛋白质组多样性的关键机制。虽然基因组包含 20,000 至 25,000 个基因,但蛋白质组估计包含超过 100 万个蛋白质。转录和 mRNA 水平的变化增加了转录组相对于基因组的大小,无数不同的翻译后修饰相对于转录组和基因组都以指数方式增加了蛋白质组的复杂性。
此外,人类蛋白质组是动态的,随着大量刺激的变化而变化,翻译后修饰常用于调节细胞活性。PTM 发生在不同的氨基酸侧链或肽键上,它们通常由酶活性介导。事实上,据估计,5% 的蛋白质组包含 200 多种类型翻译后修饰的酶。这些酶包括激酶、磷酸酶、转移酶和连接酶,它们在氨基酸侧链上添加或移除功能组、蛋白质、脂质或糖;以及蛋白酶,它们切割肽键以移除特定序列或调节亚基。许多蛋白质也可以利用自催化结构域,如自激酶和自蛋白分解结构域进行自我修饰。
翻译后修饰可以发生在蛋白质生命周期的任何阶段。例如,许多蛋白质在翻译完成后不久就被修饰,以介导适当的蛋白质折叠或稳定,或将新生蛋白质引导到不同的细胞区室(例如,细胞核、膜)。折叠和定位完成后发生其他修饰,以激活或灭活催化活性或以其他方式影响蛋白质的生物活性。蛋白质也与靶向降解蛋白质的标签共价连接。除了单一的修饰外,蛋白质通常还通过翻译后切割和通过蛋白质成熟或激活的分步机制增加功能基团的组合进行修饰。
根据修饰的性质,蛋白质 PTM 也可以是可逆的。例如,激酶在特定的氨基酸侧链上磷酸化蛋白质,这是催化激活或失活的常用方法。反之,磷酸酶水解磷酸基团将其从蛋白中去除,逆转生物活性。肽键的蛋白水解断裂是热力学上有利的反应,因此可永久去除肽序列或调节结构域。
因此,分析蛋白质及其翻译后修饰对于心脏病、癌症、神经退行性疾病和糖尿病的研究尤为重要。PTMs 的特征,虽然具有挑战性,但提供了对病因学过程下的细胞功能的无价的洞察。在技术上,研究翻译后修饰蛋白的主要挑战是开发特异性的检测和纯化方法。幸运的是,这些技术障碍正在用各种新的和精炼的蛋白质组学技术来克服。
Post-translational modifications (PTMs)
如上所述,由于存在大量不同的 PTM,无法对所有可能的蛋白质修饰进行全面审查。因此,本概述仅涉及当今蛋白质研究中研究的少数最常见类型的 PTM。此外,更多的重点放在磷酸化、糖基化和泛素化,因此这些 PTM 在各自的 PTM 专页中进行了更详细的描述。
1、Phosphorylation:
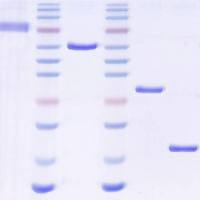
可逆的蛋白质磷酸化,主要发生在丝氨酸、苏氨酸或酪氨酸残基上,是目前研究得最深入的翻译后修饰之一。磷酸化在细胞周期、生长、凋亡和信号转导等过程中起着重要的调控作用。在以下示例中,使用蛋白免疫印迹分析评价分别用表皮生长因子 (EGF) 和血小板衍生生长因子 (PDGF) 刺激血清饥饿的 HeLa 和 NIH 3T3 癌细胞系获得的裂解物中的磷酸化蛋白特异性。
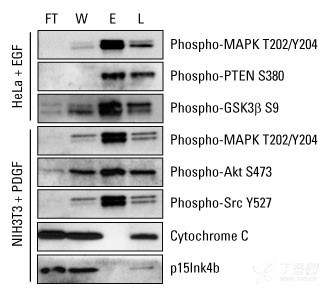
图示:从复杂生物样品中富集高纯度磷蛋白。用 theThermo Scientific Pierce 磷酸化蛋白富集试剂盒进行 Weste blot 分析,根据试剂盒说明书制备细胞裂解液,富集磷酸化蛋白。利用识别生长因子信号传导相关关键调控蛋白的磷酸化特异性抗体实现蛋白检测。细胞色素 C (pI 9.6) 和 p15Ink4b (pI 5.5) 作为非磷酸化蛋白非特异性结合的阴性对照。FT = 流穿馏分,W = 合并洗脱馏分,E = 合并洗脱馏分,L = 非富集总细胞提取物。
2、Glycosylation:
蛋白质糖基化是蛋白质翻译后的主要修饰之一,对蛋白质的折叠、构象、分布、稳定性和活性都有重要影响。糖基化包含了从核转录因子的简单单糖修饰到细胞表面受体的高度复杂分支多糖变化的蛋白质的糖部分添加的多种选择。以天冬氨酸连接(N-连接)或丝氨酸/苏氨酸连接(O-连接)寡糖形式存在的碳水化合物是许多细胞表面和分泌蛋白的主要结构成分。
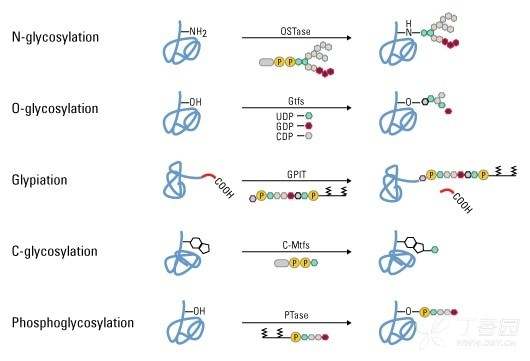
图示:糖基化的类型。糖肽键可根据连接的糖肽键和寡糖的性质分为特定的几类,包括 N-、O-和 C-连接糖基化、糖基化和磷酸化糖基化。
3、Ubiquitination:
泛素是一类分子量为 8 kDa 的多肽,由 76 个氨基酸组成,通过泛素 C 末端的甘氨酸连接到靶蛋白赖氨酸的 ε-NH2 上。在最初的单泛素化事件之后,可能形成泛素聚合物,然后 26S 蛋白酶体识别多聚泛素化蛋白,26S 蛋白酶体催化泛素化蛋白的降解和泛素的再循环。以下实验提供了检测泛素化蛋白的方法示例。
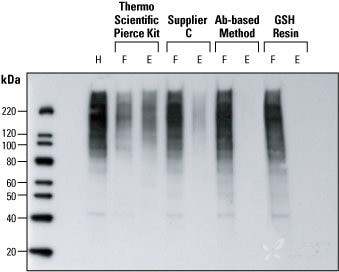
图示:HeLa 细胞裂解液中泛素的检测。进行 Weste blot 分析,比较 4 种检测 HeLa 细胞裂解液中泛素蛋白的方法。epoxomicin 处理后,通过四种不同方法处理 HeLa 细胞裂解物 (150 g)。将得到的流穿 (F) 和洗脱 (E) 馏分进行体积归一化,与原始未处理裂解物 (H) 进行体积归一化,并选择相同体积进行蛋白印迹检测。与供应商 Cs kit 和基于抗体的方法相比,thermo Scientific Pierce 泛素富集试剂盒在洗脱组分中获得了更多的泛素化蛋白(在流穿组分中获得的蛋白较少),表明泛素化蛋白的富集效果明显更好。GSH 树脂是用于比较的阴性对照。
4、S-nitrosylation:
一氧化氮 (NO) 由一氧化氮合酶 (NOS) 的三种亚型产生,它是一种化学信使,与游离半胱氨酸残基反应形成 S-硝基硫醇 (SNOs)。Snitrosylation 是细胞用来稳定蛋白质、调节基因表达和提供 NO 供体的关键 PTM,SNOs 的生成、定位、激活和分解代谢受到严格调控。
S-亚硝基化是一种可逆反应,SNOs 在细胞质中的半衰期较短,因为宿主的还原性酶,包括谷胱甘肽 (GSH) 和硫氧还蛋白 (thioredoxin),即脱硝酰基蛋白。因此,SNO 通常储存在膜、囊泡、组织间隙和亲脂性蛋白褶皱中,以保护其不脱氮。例如,介导细胞凋亡的半胱天冬酶,以 SNOs 的形式储存在线粒体膜间隙。作为对胞外或胞内信号的响应,半胱天冬酶释放到胞浆中,高度还原环境迅速使蛋白质脱硝基,导致半胱天冬酶活化并诱导细胞凋亡。
S-亚硝基化不是随机事件,只有特定的半胱氨酸残基是 S-亚硝基化。因为蛋白质可能含有多个半胱氨酸,并且由于 SNOs 的不稳定性,S-亚硝基化半胱氨酸可能难以检测并与非 S-亚硝基化氨基酸区分。Jaffrey 等人开发的生物素开关试验是检测 SNOs 的常用方法,试验步骤如下:
· All free cysteines are blocked.
· All remaining cysteines (presumably only those that are denitrosylated) are denitrosylated.
· The now-free thiol groups are then biotinylated.
· Biotinylated proteins are detected by SDS-PAGE and western blot analysis or mass spectrometry.
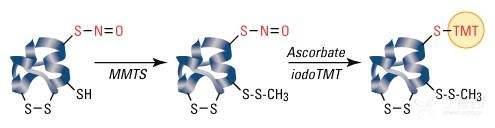
图示:S-亚硝基化 Weste Blot 试剂盒标记和检测 S-亚硝基化的反应。样品首先与 MMTS 反应,封闭 S-亚硝基化蛋白质中的游离巯基。然后用抗坏血酸盐选择性还原 snitroscysteine,并用 Thermo Scientific iodotmt zero 标记试剂进行标记。随后,使用提供的抗 TMT 抗体在免疫印迹中检测 TMT 标记蛋白。
5、Methylation:
一碳甲基转移至氮或氧(分别为 N-和 O-甲基化)至氨基酸侧链,增加了蛋白质的疏水性,当与羧酸结合时,可中和氨基酸负电荷。甲基化是由甲基转移酶介导的,S-腺苷甲硫氨酸 (SAM) 是主要的甲基供体。涉及甲硫氨酸循环。
甲基化如此频繁,以至于 SAM 被认为是 ATP 之后酶促反应中最常用的底物。此外,尽管 N-甲基化不可逆,但 O-甲基化可能可逆。甲基化是众所周知的表观遗传调控机制,因为组蛋白甲基化和去甲基化会影响 DNA 的转录可用性。氨基酸残基可以偶联到单个甲基或多个甲基上,以增加修饰的效果。
下图提供了与核小体核心颗粒相关的 PMT 的图解。
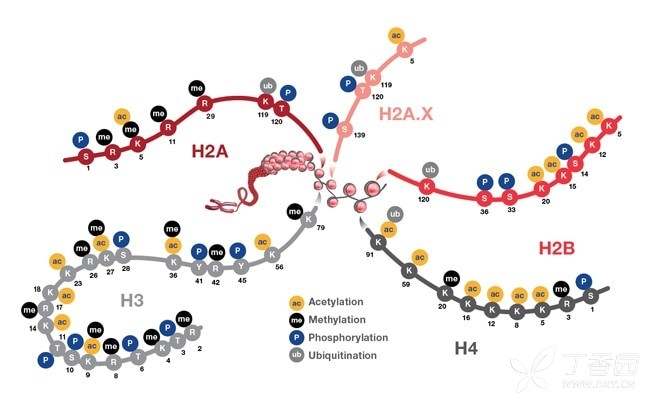
图示:与组蛋白颗粒相关的翻译后修饰。核小体由 DNA 包裹的红色球体表示(以灰色显示)。还描述了位于组蛋白 H2A(和 H2A.X)、H2B、H3 和 H4 上的 PTM 的位置。这些 PTM 通过改变染色质结构和招募组蛋白修饰因子影响基因表达。PTM 事件介导了转录激活和失活、染色体包装、DNA 损伤和修复过程等多种生物学功能。
6、N-acetylation:
几乎所有的真核细胞蛋白质都通过不可逆和可逆的机制发生 N-乙酰化,或乙酰基转移到氮上。N 端乙酰化需要 N 端蛋氨酸被蛋氨酸氨基肽酶 (MAP) 裂解,然后用 N-乙酰基转移酶 (NAT) 用乙酰辅酶 a 的乙酰基取代氨基酸。这种类型的乙酰化是共翻译的,因为 N 端在仍与核糖体相连的生长中的多肽链上乙酰化。虽然 80 至 90% 的真核细胞蛋白以这种方式乙酰化,但其确切的生物学意义仍不清楚。
组蛋白 N 末端赖氨酸的ε-NH2 乙酰化(简称赖氨酸乙酰化)是调节基因转录的常用方法。组蛋白乙酰化是一个可逆的事件,可减少染色体浓缩以促进转录,这些赖氨酸残基的乙酰化受含有组蛋白乙酰转移酶 (HAT) 活性的转录因子调控。而具有 HAT 活性的转录因子作为转录共激活因子,组蛋白去乙酰化酶 (HDAC) 酶是共抑制因子,通过降低赖氨酸乙酰化水平和增加染色体凝聚而逆转乙酰化的作用。
Sirtuins(沉默信息调节因子)是一组 NAD 依赖性去乙酰化酶,靶向组蛋白。顾名思义,它们通过低乙酰化组蛋白维持基因沉默,据报道有助于维持基因组稳定性。
而乙酰化最早是在组蛋白中检测到的,胞浆蛋白也被报道是乙酰化的,因此乙酰化似乎在细胞生物学中发挥着比单纯的转录调控更大的作用。此外,乙酰化修饰和其他翻译后修饰,包括磷酸化、泛素化和甲基化之间的串扰,可以改变乙酰化蛋白的生物学功能。可通过使用乙酰赖氨酸特异性抗体的染色质免疫沉淀 (ChIP) 或通过质谱法检测蛋白乙酰化,其中组蛋白增加 42个复合的单位代表一个单一的乙酰作用。
7、Lipidation:
脂质化是一种将蛋白质靶向作用于细胞器(内质网 [ER]、高尔基体、线粒体)、囊泡(内涵体、溶酶体)和质膜的方法。四种脂化类型为:
· C-terminal glycosyl phosphatidylinositol (GPI) anchor
· N-terminal myristoylation
· S-myristoylation
· S-prenylation
每种类型的修饰使蛋白质具有不同的膜亲和力,尽管所有类型的脂化增加了蛋白质的疏水性,从而增加了其对膜的亲和力。不同类型的脂类也不是相互排斥的,因为两种或两种以上的脂类可以附着在给定的蛋白质上。
①、GPI(glycosyl phosphatidylinositol)将细胞表面蛋白锚定在质膜上。这些疏水部分是在内质网中制备的,然后将它们整块添加到新生蛋白中。GPI 锚定蛋白通常定位在富含胆固醇和鞘脂的脂筏上,它们作为质膜上的信号平台。这种修饰是可逆的,因为 GPI 锚定蛋白可以通过磷酸肌醇特异性磷脂酶 C 被释放。事实上,这种脂肪酶被用于检测 GPI 锚定蛋白,以从膜中释放 GPI 锚定蛋白,从而进行凝胶分离和质谱分析。
②、N-肉豆蔻酰化是一种为蛋白膜定位提供疏水手柄的方法。肉豆蔻酰基是一种 14 碳的饱和脂肪酸 (C14),它使蛋白质具有足够的疏水性和对膜的亲和力,但不足以将蛋白质永久锚定在膜上。因此,N-肉豆蔻酰化可以作为一个构象定位开关,在此过程中,蛋白质构象变化影响蛋白质的可用性,用于膜连接的手柄。由于这种条件性定位,选择性定位在膜上的信号蛋白,如 Src-家族激酶,被 N-肉豆蔻酰化。
N-肉豆蔻酰基转移酶 (NMT) 专门促进 N-肉豆蔻酰化,并使用肉豆蔻酰 coa 作为底物将肉豆蔻酰基连接到 N-末端甘氨酸上。因为甲硫氨酸是所有真核生物蛋白质的 N-末端氨基酸,这个 PTM 在添加肉豆蔻酰基之前需要甲硫氨酸被上述 MAP 裂解;这是单个蛋白质上多个 PTM 的一个例子。
③、S-palmitoylation(S-棕榈酰化)通过棕榈酰酰基转移酶 (PAT) 将来自棕榈酰基 CoA 的 C16 棕榈酰基添加到半胱氨酸残基的硫醇盐侧链。由于疏水基团较长,该锚可将蛋白永久锚定在膜上。然而,这种定位可以通过破坏蛋白和锚之间连接的硫酯酶类逆转;因此,S-棕榈酰化被用作打开/关闭开关来调节膜定位。其他类型的脂质化,如肉豆蔻酰化或法尼基化(farnesylation),通常用于强化。S-棕榈酰化蛋白质也选择性地集中在脂筏上。
④、S-prenylation(S-异戊烯化)通过法尼基转移酶 (FT) 或香叶基香叶基转移酶(GGT I 和 II)共价添加法尼基 (C15) 或香叶基香叶基 (C20) 基团至 C 末端 5 个氨基酸内的特定半胱氨酸残基。与 S-棕榈酰化不同,S-异戊烯酰化具有水解稳定性。大约 2% 的所有蛋白质发生了异戊烯化,包括 Ras 超家族的所有成员。这组分子开关是法尼基化、香叶基香叶基化或两者的组合。此外,这些蛋白质在 c 末端有特定的 4 个氨基酸基序,决定了单半胱氨酸或双半胱氨酸的异戊烯化类型。异戊烯化发生在内质网,通常是 PTMs 逐步过程的一部分,随后是 Rce1 的蛋白水解裂解和异戊二烯基半胱氨酸甲基转移酶 (ICMT) 的甲基化。
8、Proteolysis:
肽键在生理条件下是无限稳定的,因此细胞需要一些机制来打破这些键。蛋白酶是一类能切割蛋白质肽键的酶,在抗原加工、细胞凋亡、表面蛋白脱落和细胞信号传导中起关键作用。
11,000 多个蛋白酶家族在底物特异性、肽裂解机制、在细胞内的位置和活性长度方面存在差异。虽然这种变化表明具有广泛的功能,但蛋白酶通常可根据蛋白水解类型分成不同的组。降解性蛋白水解对于去除未组装的蛋白质亚单位和错误折叠的蛋白质,以及通过将给定的蛋白质减少到小肽和单个氨基酸的水平来维持蛋白质浓度在稳态浓度是至关重要的。蛋白酶在细胞生物学中也发挥着生物合成的作用,包括从新生蛋白中切割信号肽和激活酶原,而酶原是无活性的酶前体,需要酶功能特定位点的裂解。在这方面,蛋白酶作为分子开关来调节酶的活性。
蛋白质水解是热力学上有利的不可逆反应。因此,蛋白酶活性受到严格调控,以避免通过时间和/或空间控制机制发生不受控制的蛋白水解,包括通过顺式或反式以及区室化(例如,蛋白酶体、溶酶体)的切割进行调控。多样的蛋白酶家族可按作用部位分类,如氨肽酶和羧肽酶,分别在蛋白的氨基端或羧基端切割。另一种类型的分类是基于参与蛋白水解的给定蛋白酶的活性位点基团。基于这种分类策略,超过 90% 的已知蛋白酶分为以下四类:
· Serine proteases
· Cysteine proteases
· Aspartic acid proteases
· Zinc metalloproteases
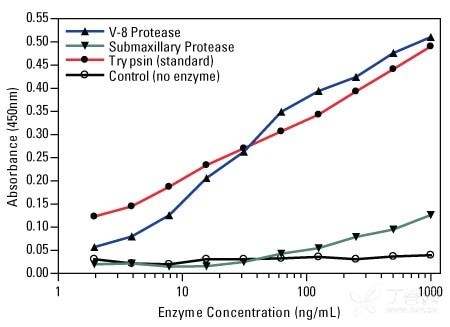
图示:比色蛋白酶试验响应曲线。采用 Thermo Scientific Pierce 比色法蛋白酶检测试剂盒,通过与提供的胰蛋白酶标准品进行比较,测定 V-8 蛋白酶和颌下腺蛋白酶消化酪蛋白底物的活性。
以上即为PTMs的概述(资料来自Thermo Fisher官网),欢迎留言评论学习!

分享一些关于磷酸化的数据库:
2、GPS(基于马尔科夫聚类算法)特点:修饰位点临近氨基酸序列相似度矩阵BLOSUM,激酶种类

4、DISPHOS(基于对数回归的线性分类器)特点:预测结果特征,二级结构预测结果特征,理化性质特征,激酶种类
如果战友有关于PTMs的网站或者数据库,可以分享在评论区,有简介更好,定有叮当奖赏!