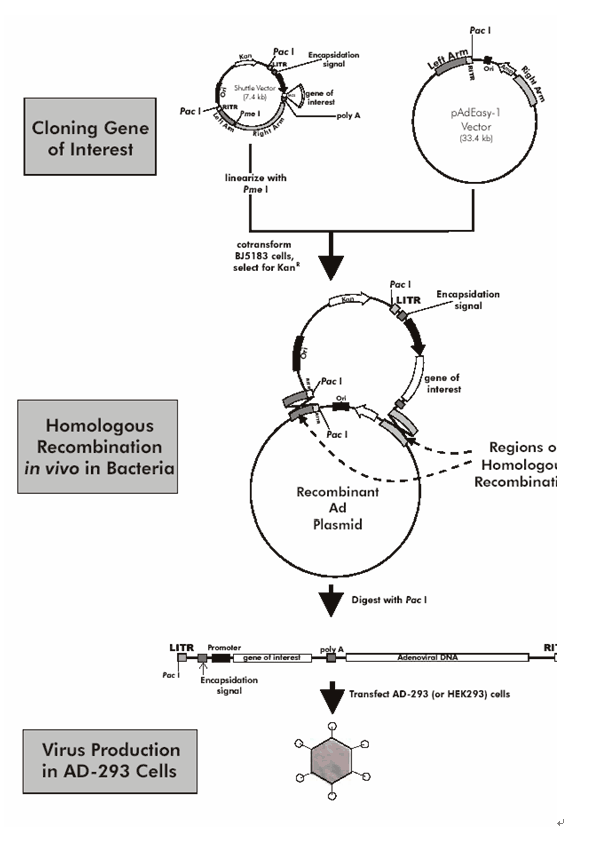
重组腺病毒构建,扩增及纯化基本技术操作
互联网
一 目的基因的克隆(以pshuttle-CMV质粒为例)
1. 选择适当酶切位点,进行酶切连接,将目的片段插入pshuttl-CMV质粒多克隆位点。
2. 重组质粒鉴定: 酶切鉴定或测序。
3. 重组质粒扩增,纯化并准备适量含目的基因的穿梭质粒。
4. 用PmeI单酶切线性化重组穿梭质粒,电泳鉴定质粒完全被切开。
5. 胶回收线性化质粒,以备共转化使用。
二 共转化
1 大肠杆菌BJ5183电转感受态制备
① 从新鲜琼脂板上挑取单个BJ5183细菌,接种于LB培养基中,37℃振摇过夜。
② 接种25ml过夜培养物于500ml LB培养基,37℃振摇,至OD600 达到0.4。
③ 迅速将培养物置于冰浴中30min,至充分冷却。
④ 将菌液转移至预冷的离心管中,4℃下以2500r/min离心15 min,弃培养液,回收细胞。
⑤ 以10ml预冷的10%甘油洗涤沉淀,低温离心,共两次。
⑥ 加约1ml(适量)预冷的10%甘油重悬沉淀,稀释悬液100倍,测量OD600,至稀释浓度为2-3×1010个细胞/ ml (1.0 OD600约2.5×1010个细胞/ml)。分装,-80℃或液氮保存待用。
2 病毒骨架质粒转化大肠杆菌,扩增,纯化。
3 将1-5μl (约1μg) 线性化的穿梭质粒及1μl(约100ng/μl)病毒骨架质粒(如pAdEasy-1)加入至含约40μl BJ5183电转感受态的EP管中混匀,冰上冷却。
4 将混合物加入电转杯,电击(1250-1500V/mm,5ms)。
5 电击结束取出样品,加入1ml SOC或LB培养液,37℃低速振荡40min。
6 取适当体积的电击转化细胞液涂于数个卡那霉素抗性平板(25-50mg/ml),37℃培养16-20hr。
7 次日挑取平板上长出的菌落(选择最小的菌落),接种于3ml含25-50mg/ml的LB培养基,37℃培养10-15hr。
8 碱裂法提取质粒,0.8%琼脂糖凝胶电泳筛选,大质粒为可能阳性克隆,进一步酶切鉴定。以PacI单酶切,0.8%琼脂糖凝胶电泳如显示出一条大片段(约30kb),及一条小片段(约3.0或4.5kb)(同时可进行其它酶切鉴定),则基本确定为阳性克隆。
9 取1-5μl 阳性质粒转化至DH5α大肠杆菌细胞(BJ5183为recA+,质粒DNA易发生突变,DH5α或JM109,XL1-blue菌株为重组缺陷性菌株,可稳定扩增已鉴定的重组质粒),扩增细菌并纯化质粒。
三 重组病毒质粒转导293细胞
1 293细胞培养:转导24小时前,以方瓶为例,接种2×106 293细胞于25cm2方瓶,使生长密度约50-70%。(也可以使用6孔或96孔板)
2 以PacI单酶切重组病毒质粒(转导25cm2方瓶约需4μgDNA),完全线性化后,乙醇沉淀,再以20 μl ddH2O溶解。
3 脂质体包裹质粒(以Lipofectamine为例):每4μg PacI约需20μl Lipofectamine包裹.质粒及脂质体分别稀释于500μl无血清培养基再混合,置于室温下15-30min。
4 以无血清培养基轻轻洗涤培养瓶,另加2.5ml无血清培养基,37℃放置10min。
5 将Lipofectamine-DNA混合物加入培养瓶,37℃孵箱放置4hr。
6 4hr后,弃Lipofectamine-DNA混合液,另加入6ml DMEM完全培养基(含10% FCS)。如有大量细胞漂浮,可不弃Lipofectamine-DNA液,加入6ml DMEM完全培养基,37℃孵育过夜,再换液。
7 培养过程中观察细胞生长情况。约2周后可观察到细胞病变(CPE)出现(如用pAdTrack-CMV质粒,由于含GFP,可观察到绿色荧光)。
四 重组病毒鉴定
1 转导10-14d后,收集细胞沉淀,加入2ml灭菌的PBS混悬,冻融细胞,离心后收集上清保存于-80℃。
2 取30-50% 步骤1中上清,感染50-70%饱和度的25cm2方瓶中293细胞。2-3d后出现明显细胞病变。
3 感染后3-5d,当1/3-1/2细胞漂浮时收集病毒。按步骤1收集细胞并准备病毒上清。通过Western blot和/或PCR鉴定重组腺病毒产生。
4 PCR鉴定重组病毒。取5μl病毒上清加入10μl蛋白酶K,55℃孵育1hr,再煮沸5min,离心后取1-2μl作PCR。
五 重组病毒扩增,纯化
1 75cm2方瓶中接种293细胞,至密度达到90%,加入适量病毒上清感染细胞。3-4d后,细胞几乎变圆,且有一半细胞漂浮,则收集所有细胞。约500g转速离心,弃上清。
2 以灭菌PBS重悬沉淀,反复冻融4次。4℃下7000g离心5min,病毒纯化至少需要30瓶75cm2方瓶细胞。
3 CsCl连续梯度离心纯化:50ml离心管中称量4.4g CsCl,加入8ml病毒裂解上清液,混匀,体积约为10ml。转移至12ml超速离心管(用于SW41转头)中,覆盖约2ml矿物油。平衡后,10℃下32000 rpm离心18-24hr,用注射器抽吸离心出的病毒带。
(也可CsCl不连续梯度离心:20ml超速离心管中缓慢加入8ml CsCl 1.4 (53 g + 87 mL 10 mM Tris-HCl,pH=7.9),上面小心加入6 mL CsCl 1.2 (26.8 g + 92 mL 10 mM Tris-HCl,pH=7.9),再小心加入病毒上清液至体积达到20ml。平衡后,4℃下 23000rpm离心90min (SW28转头),用注射器抽吸下层蓝白色病毒带)
4 病毒透析去盐:配置透析液(10 mM Tris pH 8.0, 2 mM MgCl2, 5% sucrose),灭菌处理。4℃透析,更换3次透析液,可基本去除CsCl,病毒保存于-80℃。
六 病毒滴度测定(TCID50)
1 细胞准备:96孔板中接种100μl 293细胞,每孔细胞数约104个,以2% DMEM培养。
2 稀释病毒液准备:以2% DMEM将病毒液稀释成8个较高浓度(如10-3-10-10),每个浓度重复10个,每孔加入病毒稀释液100μl。另留两排不加病毒液作为阴性对照。37℃下,孵箱培养10天。
3 10d后观察细胞,记数每排出现CPE的孔数,计算细胞病变率。(如某一浓度各孔细胞全部病变,比率为1,如无细胞病变,则比率为0)。
4 计算T =10×101 + d (S - 0.5) /ml
d = Log 10 稀释度(如为10倍稀释℃,d=1)
S = 各浓℃细胞病变比率之和
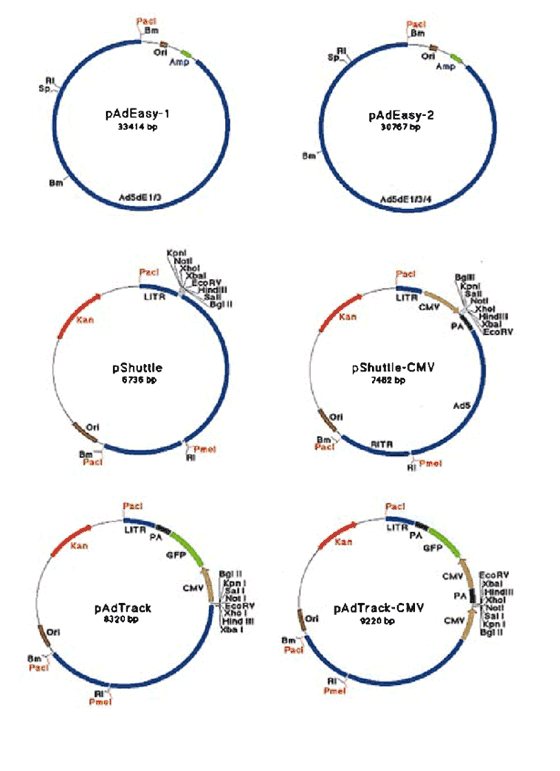
实验室重组腺病毒常用质粒:病毒骨架质粒:pAdEasy-1, pAdEasy-2
穿梭质粒:p-Shuttle, p-Shuttle-CMV, pAdTrack, pAdTrack-CMV