硝酸还原酶活力的测定(离体法)
互联网
一、原理
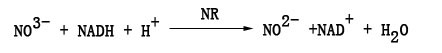
硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对–氨基苯磺酸(或对–氨基苯磺酰胺)及α–萘胺(或萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物。其反应如下:生成的红色偶氮化合物在540nm波长下有最大吸收峰,可用分光光度法测定。硝酸还原酶活性可由产生的亚硝态氮的量表示。一般以Nμg·g﹣1·h﹣1为单位。NR的测定可分为活体法和离体法。活体法步骤简单,适合快速、多组测定。离体法复杂,但重复性较好。
二、仪器与用具
离心机;分光光度计;冰箱;研钵;试管等用具同活体法。
三、试剂
1. 0.1mol/L pH7.5的磷酸缓冲液;0.1mol/L KNO3磷酸缓冲液;1%(W/V)对–氨基苯磺酸溶液;0.2%(W/V)α-萘胺溶液(上述溶液配法同活体法)。
2. NADH2溶液:称取2.0mg NADH2溶于1ml 0.1mol/L的磷酸缓冲液中(冰箱贮存可用一星期);
3. 提取缓冲液(25mmol/L的磷酸缓冲液、5mmol/L半胱氨酸、5mmol/L EDTA-Na2混合液):取250ml 0.1mol/L磷酸缓冲液,加半胱氨酸0.61g;EDTA-Na2 1.86g,溶解后用KOH溶液调pH至7.5,定容1000ml。
四、方法
1. 取材料2g,洗净剪碎,放在研钵中置低温冰箱冷冻30min。取出在冰浴中加少量石英砂和提取缓冲液(玉米、小麦、水稻分别按每克鲜重1ml,2ml和4ml分两次加入)。研磨为匀浆,低温离心5min(4000r/min)。上清液即为粗酶提取液。上述操作尽量在冰浴中进行。
2. 取0.4ml粗酶提取液,1.2ml 0.1mol/L KNO3磷酸缓冲液,0.4ml NADH2溶液加入备好的刻度试管中混匀,在30℃下保温30min,对照不加NADH2,以0.4ml蒸馏水代替。
3. 保温后立即加1ml对-氨基苯磺酸溶液终止反应,加1mlα-萘胺溶液,显色20min,在台式离心机上离心10min,上清液在分光光度计上测波长540nm处光密度。
4. 标准曲线制作和结果计算同活体法。
五、注意事项
1. 硝酸盐还原过程应在黑暗中进行,以防止亚硝酸盐还原为氨。加异丙醇可增加组织对NO3-和NO2-的透性,厌氧条件可防止氧竞争还原吡啶核苷酸。
2. 取样前材料应照光3h以上,大田取样在上午9点后为宜,阴雨天不宜取样。取样部位应尽量一致。
3. 配好的KNO3磷酸缓冲液应密闭低温保存,否则易滋生微生物将NO3-还原,使对照吸光值偏高。
4. 从显色到比色时间要一致,过短过长对颜色有影响。