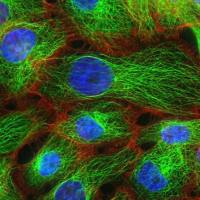
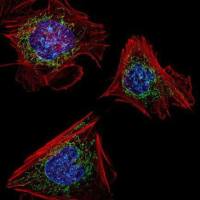
细胞系或细胞株的建立
互联网
一、概念
1、细胞系(Cell Line):原代培养舞经首次传代成功即成细胞系,由原先存在于原代培养物中的细胞世系(Lineage of Cells)所组成。
2、细胞株(Cell Strain):通过选择法或克隆形成法从原代培养物或细胞系中获得具有特殊性质或标志物称为细胞株。细胞株的特殊性质或标志必须在整个培养期间始终存在。如果不能继续传代或传代数有限,称为有限细胞株(finitecell strain);如果可以连续传代,称为连续细胞株(continuous cell strain)。对于人类肿瘤细胞,在体外培养半年以上,生长稳定,并连续传代的即可称为连续性株或系。
二、建立细胞系(或株)的要求
什么样的体外培养群可被认可为己鉴定的细胞,视具体情况而定,无统一规定。对于用作原代培养的细胞只要供体均一,取材部位及组织种类等条件稳定即可,如用做长期培养,特别是反复传代的细胞,常需做如下说明:
1、组织来源:细胞供体所属物种,来自人体或者动物;
个体性别、年龄;取材的器官或组织。
如系肿瘤组织,应说明临床和病理诊断,以及病历号等。
2、细胞生物学检测:
了解细胞一般和特殊的生物学性状,如细胞一般形态,特异结构,细胞生长曲线和分裂指数,倍增时间,接种率等。
如为肿瘤细胞,为说明来源于原肿瘤组织并保持恶性,须做软琼脂培养,异体接种致瘤和对正常组织侵润力等实验。
3、培养条件和方法;应说明细胞系(或株)适应的生存环境,即指明使用的培养基、血清种类、用量以及适宜PH值。
三、若干细胞建株的要点及基本过程
(一)肿瘤细胞培养技术要点
1、取材:材料主要来源于外科手术或活检瘤组织,取材时避免用坏死组织,要挑选瘤细胞集中和活力较好的部位,瘤性转移淋巴结或胸腹水是较好的培养材料。取材后尽快培养,因故不能立即培养者,可冻存。其培养方法及冻存方法同前述正常组织。
2、成纤维细胞排除:在肿瘤组织中常混杂有一些成纤维细胞,培养时能与瘤细胞同时生长,并常压过癌细胞,导致癌细胞生长受阻以至消失,应仔细排除。
排除方法常有:机械刮除法、反复贴壁法、消化排除法、胶原酶消化法等。
3、提高肿瘤细胞培养存活率和生长率
根据实验经验,肿瘤细胞在体外不易培养,建立能传代的肿瘤细胞系更为困难。一般当肿瘤组成或细胞被原代培养后,要经过对新环境的适应才能生长,因此不能局限于一般培养法,须采用一些特殊措施。如:用适宜底物,鼠尾胶原底层及饲细胞底层等。用细胞生长因子,根据细胞种类不同选用不同的促细胞生长因子,如胰岛素、氢化可的松,雌激素等。也可以考虑动物媒介培养。
(二)人类淋巴母细胞建株方法
l、4ml肝素抗凝血于离心管中,加入2ml RPMI 1640。
2、混匀后沿管壁缓慢加到预置有4ml淋巴细胞分离液的液面上静置30min。
3、1500rpm,15min,吸取白细胞层(第二层)于另一离心管中。
4、加RPMI 1640 5ml洗涤白细胞两次。
5、将白细胞接种至1ml RPMI 1640培养基中,加入10μl环胞霉素和100μl的EBV(EB病毒)液,混匀。
6、水浴摇床,40次/分,37℃,3hr。
7、1500rpm,15min。将细胞接种至1ml培养基中(内含谷氨酰胺1mM/ml)加入10μl环胞霉素,轻轻混匀,37℃培养。
8、5天后观察细胞转化和生长情况,决定是否半量换液。一般半量换液l—2次,并维持环胞霉素的浓度。
9、待转化细胞数量明显上升,并出现细胞团块后,可转入25ml细胞培养瓶中,加1—2ml培养基,37℃培养10—15天,一般每隔3—4天观察一次,决定是否换液,传代。
10、细胞生长达一定数量后冻存,冻存前应进行核型分析和存档。