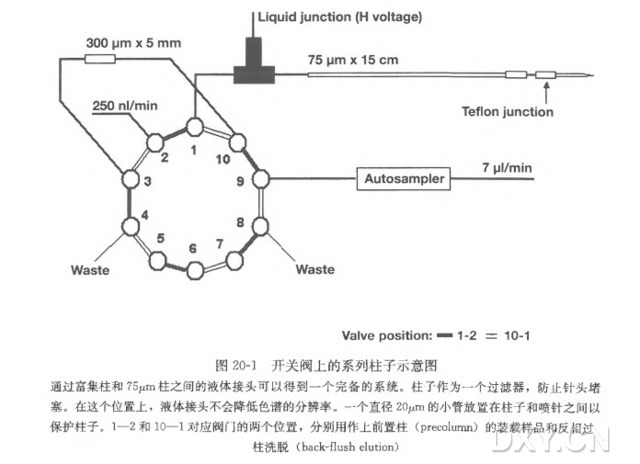
水稻叶片和根蛋白质的纳升级二维液相色谱串联质谱
丁香园
2248
1. 前言
应用于复杂的肽复合物分离和鉴定的纳升级 2D 液相色谱串联质谱(LC-MS/MS ) 技术的发展,是近年来蛋白质组学领域最重要的进展之一 [ 1,2] ,这种技术通常被称为多维肽段鉴定技术(Mudpit) [3] 。该方法首先将复杂的蛋白混合物用一种蛋白酶(如胰蛋白酶)消化成一组大小不一的肽段混合物,然后用相互垂直的二维液相色谱分离这个肽段混合物,用这种二维液相色谱技术分离肽混合物不是各相液相色谱分离组分的简单算术总和,而是根据肽在各相液相色谱中的迁移特性,最终获得分离的肽产物组分 [ 4,5 ] 。
这个方法的优势是它不会有在 2D 蛋白凝胶电泳中常发生的由于蛋白质的极端大小,疏水性以及等电点等方面造成的偏差,而且这个方法可以在相对较短的时间内对于给定的样品获得大量的蛋白质鉴定数据。但是,这个方法也存在一些缺点,如技术要求高 ,重复性不好,因此它不适合分析蛋白表达量差异微弱的两个样品。最近有研究报道[ 6,7] ,通过利用 N15 代谢标记生物体,如酵母和大肠杆菌,进行多维蛋白定量分析两个细胞状态间的蛋白质表达的变化。但是,这种方法只能用于能被 N15 代谢标记的生物体上,因此不适用于植物组织。
Mudpit 这个术语最初被用于描述一种非常特别的实验设计;这个实验使用一根带有一个整合纳米电喷头,并填装强阳离子交换和反相物质的双相熔融石英毛细管层析柱。随后的报告中将这个术语用于描述几乎任何涉及双向色谱层析分离的所有实验体系。许多这种实验体系涉及大量的连接部分,死区容积和组分收集 (伴随着固有的损耗),因此它们对肽段和蛋白的层析分离和鉴定的效率均不如传统的方法。因此,人们转而使用多种填装有离线双层析柱系统的二维色谱来分离肽段和蛋白,然而,用 Mudpit 分析来表述这些二维色谱系统事实上是不准确的。由于这些二维色谱系统在组分收集时不可避免的损耗,以及蛋白质附着于大孔径层析系统的巨大表面上,这些二维色谱系统需要大量的蛋白质样品来做实验。相对于其他材料来说,植物蛋白质组学研究仍然处在相对较早的发展时期。在撰写本文的时候,我们简单搜索 “proteomics” 关键词,可以从美国国家生物技术信息中心 ( NCBI) Pubmed 出版物数据库中检索到 4704 篇文章,但是简单搜索 “plant proteomics”关键词,却只能检索到 260 篇文章,这意味着在所有的蛋白质组学研究中,大约 95% 是在植物以外的其他物种中开展的。最近发表的大多数文献仍然是在用质谱鉴定蛋白质之前,依赖于双向凝胶电泳来分离蛋白。但是,有关非双向凝胶方法使用的报道在不断增加,如离线双向液相色谱分离 [8] ,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE ) 分离,蓝绿非变性胶分离 [11] ,溶剂分馏,运用二维纳升级液相层析柱进行的 Mudpit [12]。
新技术在植物蛋白质组学研究领域的应用还受到一些客观因素的限制。首先是相对较少的植物基因组序列信息,水稻[ 13~15 ]和拟南芥[16~18] 是迄今为止公布基因组序列信息的植物。当然,这种现象很快将得到明显的改善,如玉米 [19] 的完整基因组测序工作已经开始。
植物蛋白质组学关注的另一个问题是:植物组织的样品制备要比细菌或者人类体液这种样品的制备更加困难。植物组织包含大量的维护细胞结构的细胞壁蛋白和多糖,叶绿体光合作用蛋白以及可能是这个星球上最丰富的重要代谢蛋白质——核酮糖-1,5 - 二磷酸羧化酶(RuBisCo) 。在含有许多低丰度蛋白的样品里存在少数高丰度蛋白将会为蛋白质分析带来较大的困难,特别是在 Mudpit 分析中,这些高丰度蛋白占用仪器宝贵的分析时间,降低分析混合物中其他肽段和蛋白质的成功率。植物组织材料还带来一个实际操作的问题,即从植物材料中抽提蛋白质一般采用液氮研磨,然后用三氯乙酸和丙酮沉淀 [ 20] ,结果得到一种含有蛋白质和大量难溶物质的浅棕色的纤维物质。用 Mudpit 方法很难从这种纤维物质中抽提出足够的蛋白质,分析前的反复抽提倒是可以解决这个困难。
尽管有这么多的问题,Mudpit 分析依然是一种能在较短的时间内获得大量的蛋白质鉴定信息的最好方法之一。将来更多的植物基因组序列信息将有助于应用 Mudpit 分析技术对任何植物组织材料的表达蛋白质组进行归类,以及应用纳升级气质联用 LCMS/MS 进行蛋白质跨物种鉴定。尽管小麦基因组序列数据非常少,但我们此前通过利用水稻基因组序列信息 [ 15 ] ,结合运用这种分析方法,成功地分析了小麦中的淀粉体 [9] 。
需要特别指出的是,基质辅助激光解吸电离(MALDI) 肽段收集指纹谱识别技术只能用来鉴定大多数熟知的蛋白,鉴定未知蛋白的成功率很低 [21] ,因此,这样的实验必须用 MS/MS 技术鉴定未知的肽段。
此外,还有一点需要重视的是,植物拥有相当大的基因组,如水稻拥有超过 30000 个的基因,这意味着它有较大的潜在蛋白表达区域。就算最好的 Mudpit 分析系统也只能在一个实验中鉴定 1000~1500 个蛋白质,所以一个 Miidpit 分析实验对植物组织材料来说,还不能认为是个全面的蛋白质组学分析。更多的蛋白表达和鉴定信息还是要通过柱切换多维分离技术获得,如在用 Mudpit 分析蛋白质组分之前先根据分子质量和电荷的差异分离蛋白质组分,或者先用 SDS-PAGE 或等电聚焦方法分离蛋白质,然后再用纳升级液质联用系统,气质联用系统 [ 23,24 ] 或其他一些类似的综合系统分析蛋白质。
本章节阐释毛细管双相 Mudpit 系统在分析水稻叶和根的蛋白提取物中的应用,从植物幼苗开始,详细介绍具代表性蛋白质的鉴定信息,并对每个分析样品的蛋白质鉴定做了总结。
2. 材料
2.1 仪器设备
( 1 ) 串连质谱:离子讲串联质谱仪 Thermo LCQ DecaXP Plus (Thermo Electron,Sanjose, CA ) 。
( 2 ) 纳喷雾离子源:美国亚利桑那大学 Chemistry Department Machine Shop 制造,也可用 Thermo Electron,New Objectives 公司(Woburn, MA) , 或者 Brechbuehler 公司(Houston,TX ) 的商业产品。
( 3 ) Surveyor 自动进样器(Thermo Electron 公司)。
( 4 ) Surveyor 微管径高效液相色谱(Thermo Electron 公司)。
( 5 ) P2000 激光加热型微电极拉制仪(Sutter Instrument 公司,Novato, CA ) 。
( 6 ) 氦压柱填充室(Brechbuehler 公司,Houston, TX ) 。
( 7 ) 特氟隆管压力室,1/16 英寸至 0.4 mm ( Chromatography Research Supplies 公司,Louisville, KY)。
( 8 ) SpeedVac 真空干燥浓缩机(Savant Instruments 公司,Farmingdale,NY ) 。
( 9 ) 旋涡振荡仪(Barnstead 公司,Dubuque,IA ) 。
2.2 HPLC 缓冲液和柱子装填材料
( 1 ) 缓冲液 A : 0.1% 甲酸( 98%~100%,EMDChemical, Gibbstown, NJ) 。
( 2 ) 缓冲液 B : 乙腈,0.1% 甲酸。
( 3 ) 缓冲液 C : 95% 250 mmol/L 乙酸铵,5% 乙腈,0.1% 甲酸。
( 4 ) 缓冲液 D : 95% 1.5 mmol/L 乙酸铵,5% 乙腈,0.1% 甲酸。
( 5 ) 溶融石英:100 μm ID X 360 μm OD ( Polymicro Technologies, Phoenix, AZ ) 。
( 6 ) 反相装填材料:Zorbax Eclipse XDB- C18 5 μm ( Agilent Technologies, PaloAlto , CA )。
( 7 ) 阳离子交换装填材料:Poly SulfoethylA ( PolyLC 公司, Columbia, MD) 。
( 8 ) C18 Sep-Pak 固相抽提柱(Waters, Bedford公司, MA) ,一只 10 ml —次性塑料注射器。
( 9 ) 9Spec-Plus PT C18 固相移液器吸头(Varian公司, LakeForest, CA ) 。
2.3 化学试剂、缓冲液、溶液和酶
( 1 ) Milli-Q 水(18 MΩ 电阻)。
( 2 ) 叶片重悬液:用丙酮配制 10% 三氯乙酸(TCA ) ,0.07% (V/V ) 巯基乙醇。
( 3 ) EDTA 漂洗液:用丙酮配制 0.07% (V/V ) 巯基乙醇(Sigma, St. Louis,MO),2 mmol/L EDTA ( Sigma, St. Louis, MO)。
( 4 ) HPLC 级乙腈(EMD Chemical) 。
( 5 ) HPLC 级甲醇(EMD Chemical) 。
( 6 ) 用水配制 0.1% 甲酸溶液。
( 7 ) 用 90% 乙腈配制 0.1% 甲酸溶液。
( 8 ) 100 mmol/L 碳酸氢铵溶液。
( 9 ) 100 mmol/L 氯化钙溶液。
( 10 ) Proteomics 级的胰蛋白酶(Sigma:10 mmol/L 盐酸配制浓度为:1 μg/μl ) 。
( 11 ) 内切赖氨酸-C蛋白酶(Roche Diagnostics, Indianapolis, IN ):10 mmol/L 盐酸中配制 0.2 μg/μl。
( 12 ) 乙醇(EMD Chemical) 。
( 13 ) 三氯乙酸(EMD Chemical) 。
( 14 ) 丙酮(EMD Chemical) 。
( 15 ) 尿素(Bio-Rad,Hercules,CA )。
4. 注释
( 1 ) 这个洗涤步骤对于解决由于 TCA 残留而引起的抽提蛋白混合物 pH 过低问题是很有必要的。因为蛋白酶在酸性 pH 下不能发挥最佳功能,所以残留的酸会带来不好的实验结果。
( 2 ) 用标准蛋白定量方法检测抽提蛋白样品的蛋白质浓度。当抽提的蛋白样品浓度过低时,可将多次抽提样品经 TCA/丙酮沉淀后汇总在一起,然后进行蛋白质定量分析。
( 3 ) 虽然胰蛋白酶在 8 mol/L 尿素中无活性,但胞内蛋白酶赖氨酸-C 在该条件下依然有活性,该步骤是可选步骤,选择该步骤的理由是,经由赖氨酸-C 消化有助于去除某些 3D 结构,有利于下一步的胰蛋白酶消化作用。
( 4 ) Spec-plus C18 吸头中的液体可在重力作用下流动,但经常会留下一半的液体。在这个吸头上连接一个 3 ml 塑料注射器施以很低的压力,就可以重新恢复流动。
( 5 ) 这步不需要自动进样器,但是我们实验室的仪器系统配置了自动进样器。样品也可以使用手动注射器或直接通过压力室打进双相层析柱中。
( 6 ) 初始 C18 梯度常常含有大量的样品,特别是那些复杂的蛋白质混合物。如果这种情况发生,将 5%~50% 的 B 梯度分离时间延长至 90~120 min,比本文介绍的 60 min 梯度分离,可明显增加更多的蛋白质鉴定数量。
参考文献
1. Link, A. J., Eng, J., Schieltz, D. M., et al. (1999) Direct analysis of protein complexes using mass spectrometry. N a t. B io te c h n o l. 17, 676-682.
2. Washburn, M . P., Wolters, D., and Yates, J. R. Ill (2001) Large-scale analysis ofthe yeast proteome by multidimensional protein identification technology. N a t.B io te c h n o l. 19, 242-247.
3. Haynes, P. A. and Yates, J. R. Ill (2000) Proteome profiling-pitfalls and progress.Y e a s t 17, 81-87.
4. Opiteck, G. J. and Jorgenson, J. W . (1997) Two-dimensional S E C / R P L C coupledto mass spectrometry for the analysis of peptides. A n a l. Ch em . 69, 2283-2291.
5. Opiteck, G. J., Lewis, K. C., Jorgenson, J. W., and Anderegg, R. J. (1997) Comprehensive on-line L C / L C / M S of proteins. A n a l. C h em . 69, 1518-1524.
6. Washburn, M . P., Ulaszek, R., Deciu, C., Schieltz, D. M., and Yates, J. R. Ill(2002) Analysis of quantitative proteomic data generated via multidimensionalprotein identification technology. A n a l. C h em .74, 1650-1657.
7. W u , C. C., MacCoss, M . J., Howell, K. E., Matthews, D. E., and Yates, J. R. 3rd(2004) Metabolic labeling of m a m m a l i a n organisms with stable isotopes for quantitative proteomic analysis. A n a l. C h em .76, 4951— 4959.
8. Froehlich, J. E., Wilkerson, C. G., Ray, W . K., et al. (2003) Proteomic study of theArabidopsis thaliana chloroplastic envelope m e m b r a n e utilizing alternatives totraditional two-dimensional electrophoresis. J. P r o te o m e R es. 2, 413-425.
9. Andon, N. L., Hollingworth, S., Koller, A., Greenland, A. J., Yates, J. R. Ill, andHaynes, P. A. (2002) Proteomic characterization of wheat amyloplasts using identification of proteins by tandem mass spectrometry. P r o te o m ic s 2, 1156-1168.
10. Peltier, J. B., Ytterberg, A. J., Sun, Q., and van Wijk, K. J. (2004) N e w functionsof the thylakoid m e m b r a n e proteome of A r a b id o p s is th a lia n a revealed by asimple, fast, and versatile fractionation strategy. J. B io l. Ch em . 279, 49367-4983.
11. Heinemeyer, J., Eubel, H., W e h m h o n e r , D., Jansch, L., and Braun, H. P. (2004)Proteomic approach to characterize the supramolecular organization of photosystems in higher plants. P h y to c h e m is tr y 65, 1683-1692.
12. Koller, A., Washburn, M . P., Lange, B. M., et al. (2002) Proteomic survey ofmetabolic pathways in rice. P ro c. N a tl. A c a d . S ci. U SA 99, 11969-11974.
13. Chen, M., Presting, G., Barbazuk, W . B., et al. (2002) A n integrated physical andgenetic m a p of the rice genome. P la n t C e ll 14, 537-545.
14. Yu, J., Hu, S., W a n g , J., et al. (2002) A draft sequence of the rice g e n o m e (O r yzas a tiv a L. ssp. indica). S c ie n c e 296, 79-92.
15. Goff, S. A., Ricke, D., Lan, T. H., et al. (2002) A draft sequence of the rice g e n o m e( O r yz a s a tiv a L. ssp. japonica). S c ie n c e 296, 92-100.
16. Initiative, A. G. (2000) Analysis of the g e n o m e sequence of the flowering plantA r a b id o p s is th a lia n a . N a tu r e 408, 796-815.
17. Salanoubat, M., Lemcke, K., Rieger, M., et al.. (2000) Sequence and analysis ofc h r o m o s o m e 3 of the plant A r a b id o p s is th a lia n a . N a tu r e 408, 820-822.
18. Tabata, S., Kaneko, T., Nakamura, Y., et al. (2000) Sequence and analysis ofc h r o m o s o m e 5 of the plant A r a b id o p s is th a lia n a . N a tu r e 408, 823-826.
19. Lunde, C. F., Morrow, D. J., Roy, L. M., and Walbot, V. (2003) Progress in maizegene discovery: a project update. F u n d . I n te g r . G e n o m ic s 3, 25-32.
20. Damerval, C., de Vienne, D., Zivy, M., and Thiellement, H. (1986) Technicalimprovements in two-dimensional electrophoresis increase the level of geneticvariation detected in wheat-seedling proteins. E le c tr o p h o r e s is 7, 52— 54.
21. Porubleva, L., Vander Velden, K., Kothari, S., Oliver, D. J., and Chitnis, P. R.(2001) T h e proteome of maize leaves: use of gene sequences and expressedsequence tag data for identification of proteins with peptide mass fingerprints.E le c tr o p h o r e s is 22, 1724-1738.
22. Zuo, X., Echan, L., Hembach, P., et al. (2001) Towards global analysis of mammalian proteomes using sample prefractionation prior to narrow p H range two-dimensional gels and using one-dimensional gels for insoluble and large proteins.E le c tr o p h o r e s is 22, 1603-1615.
23. Blonder, J., Hale, M . L., Lucas, D. A., et al. (2004) Proteomic analysis of detergent-resistant m e m b r a n e rafts. E le c tr o p h o r e s is 25, 1307-1318.
24. Guina, T., W u , M., Miller, S. I., et al. (2003) Proteomic analysis of P s e u d o m o n a sa e r u g in o s a grown under m a g n e s i u m limitation. J. A m . S o c. M a s s S p e c tr o m . 14,742-751.
25. Gatlin, C. L., Kleemann, G. R., Hays, L. G., Link, A. J., and Yates, J. R. 3rd(1998) Protein identification at the low femtomole level from silver-stained gelsusing a n e w fritless electrospray interface for liquid chromatography-microsprayand nanospray mass spectrometry. A n a l. B io c h e m . 263, 93-101.
26. Eng, J., M c C o r m a c k , A. L., and Yates, J. R. Ill (1994) A n approach to correlatetandem mass spectral data of peptides with amino acid sequences in a proteindatabase. J. A m . M a s s S p e c tr o m . 5, 976-989.
27. Yates, J. R. Ill, Eng, J. K., M c C o r m a c k , A. L., and Schieltz, D. (1995) A methodto correlate tandem mass spectra of modified peptides to amino acid sequences inthe protein database. A n a l. C h em . 67, 1426-1436.
28. Perkins, D. N., Pappin, D. J., Creasy, D. M., and Cottrell, J. S. (1999) Probability-based protein identification by searching sequence databases using mass spectrometry data. E le c tr o p h o r e s is 20, 3551-3567.
29. Creasy, D. M . and Cottrell, J. S. (2002) Error tolerant searching of uninterpretedtandem mass spectrometry data. P r o te o m ic s 2, 1426-1434.
30. Craig, R. and Beavis, R. C. (2003) A method for reducing the time required tomatch protein sequences with tandem mass spectra. R a p id C o m m u n . M a s sS p e c tr o m . 17, 2310-2316.
31. Craig, R. and Beavis, R. C. (2004) T A N D E M : matching proteins with tandemmass spectra. B io in fo r m a tic s 20, 1466-1467.
32. Nesvizhskii, A. I., Keller, A., Kolker, E., and Aebersold, R. (2003) A statisticalmodel for identifying proteins by tandem mass spectrometry. A n a l. C h em . 75,4 6 4 6 4 6 5 8 .
33. Sadygov, R. G., Liu, H., and Yates, J. R. (2004) Statistical models for proteinvalidation using tandem mass spectral data and protein amino acid sequence databases. A n a l. Ch em . 76, 1664-1671.
34. Peng, J., Elias, J. E., Thoreen, C. C., Licklider, L. J., and Gygi, S. P. (2003)Evaluation of multidimensional chromatography coupled with tandem massspectrometry ( L C / L C - M S / M S ) for large-scale protein analysis: the yeastproteome. J. P r o te o m e R es . 2 , 43-50.
35. Elias, J. E., Gibbons, F. D., King, O. D., Roth, F. P., and Gygi, S. P. (2004) Intensity-based protein identification by machine learning from a library of tandemmass spectra. N a t. B io te c h n o l. 22, 214-219.
36. Breci, L., Hattrup, E., Keeler, M., Letarte, J., Johnson, R., and Haynes, P. A.(2005) Comprehensive proteomics in yeast using chromatographic fractionation,gas phase fractionation, protein gel electrophoresis, and isoelectric focusing.P r o te o m ic s 5, 2018-2028.
37. Hall, N., Karras, M., Raine, J. D., et al. (2005) A comprehensive survey of thePlasmodium life cycle by genomic, transcriptomic, and proteomic analyses. Science 307 , 82-86.
38. Vitali, B., Wasinger, V., Brigidi, P., and Guilhaus, M . (2005) A proteomic viewof B ifid o b a c te r iu m in fa n tis generated by multi-dimensional chromatographycoupled with tandem mass spectrometry. P r o te o m ic s 5, 1859-1867.
39. Durr, E., Yu, J., Krasinska, K. M., et al. (2004) Direct proteomic mapping of thelung microvascular endothelial cell surface in vivo and in cell culture. N a t.B io te c h n o l. 22, 985— 992.
应用于复杂的肽复合物分离和鉴定的纳升级 2D 液相色谱串联质谱(LC-MS/MS ) 技术的发展,是近年来蛋白质组学领域最重要的进展之一 [ 1,2] ,这种技术通常被称为多维肽段鉴定技术(Mudpit) [3] 。该方法首先将复杂的蛋白混合物用一种蛋白酶(如胰蛋白酶)消化成一组大小不一的肽段混合物,然后用相互垂直的二维液相色谱分离这个肽段混合物,用这种二维液相色谱技术分离肽混合物不是各相液相色谱分离组分的简单算术总和,而是根据肽在各相液相色谱中的迁移特性,最终获得分离的肽产物组分 [ 4,5 ] 。
这个方法的优势是它不会有在 2D 蛋白凝胶电泳中常发生的由于蛋白质的极端大小,疏水性以及等电点等方面造成的偏差,而且这个方法可以在相对较短的时间内对于给定的样品获得大量的蛋白质鉴定数据。但是,这个方法也存在一些缺点,如技术要求高 ,重复性不好,因此它不适合分析蛋白表达量差异微弱的两个样品。最近有研究报道[ 6,7] ,通过利用 N15 代谢标记生物体,如酵母和大肠杆菌,进行多维蛋白定量分析两个细胞状态间的蛋白质表达的变化。但是,这种方法只能用于能被 N15 代谢标记的生物体上,因此不适用于植物组织。
Mudpit 这个术语最初被用于描述一种非常特别的实验设计;这个实验使用一根带有一个整合纳米电喷头,并填装强阳离子交换和反相物质的双相熔融石英毛细管层析柱。随后的报告中将这个术语用于描述几乎任何涉及双向色谱层析分离的所有实验体系。许多这种实验体系涉及大量的连接部分,死区容积和组分收集 (伴随着固有的损耗),因此它们对肽段和蛋白的层析分离和鉴定的效率均不如传统的方法。因此,人们转而使用多种填装有离线双层析柱系统的二维色谱来分离肽段和蛋白,然而,用 Mudpit 分析来表述这些二维色谱系统事实上是不准确的。由于这些二维色谱系统在组分收集时不可避免的损耗,以及蛋白质附着于大孔径层析系统的巨大表面上,这些二维色谱系统需要大量的蛋白质样品来做实验。相对于其他材料来说,植物蛋白质组学研究仍然处在相对较早的发展时期。在撰写本文的时候,我们简单搜索 “proteomics” 关键词,可以从美国国家生物技术信息中心 ( NCBI) Pubmed 出版物数据库中检索到 4704 篇文章,但是简单搜索 “plant proteomics”关键词,却只能检索到 260 篇文章,这意味着在所有的蛋白质组学研究中,大约 95% 是在植物以外的其他物种中开展的。最近发表的大多数文献仍然是在用质谱鉴定蛋白质之前,依赖于双向凝胶电泳来分离蛋白。但是,有关非双向凝胶方法使用的报道在不断增加,如离线双向液相色谱分离 [8] ,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE ) 分离,蓝绿非变性胶分离 [11] ,溶剂分馏,运用二维纳升级液相层析柱进行的 Mudpit [12]。
新技术在植物蛋白质组学研究领域的应用还受到一些客观因素的限制。首先是相对较少的植物基因组序列信息,水稻[ 13~15 ]和拟南芥[16~18] 是迄今为止公布基因组序列信息的植物。当然,这种现象很快将得到明显的改善,如玉米 [19] 的完整基因组测序工作已经开始。
植物蛋白质组学关注的另一个问题是:植物组织的样品制备要比细菌或者人类体液这种样品的制备更加困难。植物组织包含大量的维护细胞结构的细胞壁蛋白和多糖,叶绿体光合作用蛋白以及可能是这个星球上最丰富的重要代谢蛋白质——核酮糖-1,5 - 二磷酸羧化酶(RuBisCo) 。在含有许多低丰度蛋白的样品里存在少数高丰度蛋白将会为蛋白质分析带来较大的困难,特别是在 Mudpit 分析中,这些高丰度蛋白占用仪器宝贵的分析时间,降低分析混合物中其他肽段和蛋白质的成功率。植物组织材料还带来一个实际操作的问题,即从植物材料中抽提蛋白质一般采用液氮研磨,然后用三氯乙酸和丙酮沉淀 [ 20] ,结果得到一种含有蛋白质和大量难溶物质的浅棕色的纤维物质。用 Mudpit 方法很难从这种纤维物质中抽提出足够的蛋白质,分析前的反复抽提倒是可以解决这个困难。
尽管有这么多的问题,Mudpit 分析依然是一种能在较短的时间内获得大量的蛋白质鉴定信息的最好方法之一。将来更多的植物基因组序列信息将有助于应用 Mudpit 分析技术对任何植物组织材料的表达蛋白质组进行归类,以及应用纳升级气质联用 LCMS/MS 进行蛋白质跨物种鉴定。尽管小麦基因组序列数据非常少,但我们此前通过利用水稻基因组序列信息 [ 15 ] ,结合运用这种分析方法,成功地分析了小麦中的淀粉体 [9] 。
需要特别指出的是,基质辅助激光解吸电离(MALDI) 肽段收集指纹谱识别技术只能用来鉴定大多数熟知的蛋白,鉴定未知蛋白的成功率很低 [21] ,因此,这样的实验必须用 MS/MS 技术鉴定未知的肽段。
此外,还有一点需要重视的是,植物拥有相当大的基因组,如水稻拥有超过 30000 个的基因,这意味着它有较大的潜在蛋白表达区域。就算最好的 Mudpit 分析系统也只能在一个实验中鉴定 1000~1500 个蛋白质,所以一个 Miidpit 分析实验对植物组织材料来说,还不能认为是个全面的蛋白质组学分析。更多的蛋白表达和鉴定信息还是要通过柱切换多维分离技术获得,如在用 Mudpit 分析蛋白质组分之前先根据分子质量和电荷的差异分离蛋白质组分,或者先用 SDS-PAGE 或等电聚焦方法分离蛋白质,然后再用纳升级液质联用系统,气质联用系统 [ 23,24 ] 或其他一些类似的综合系统分析蛋白质。
本章节阐释毛细管双相 Mudpit 系统在分析水稻叶和根的蛋白提取物中的应用,从植物幼苗开始,详细介绍具代表性蛋白质的鉴定信息,并对每个分析样品的蛋白质鉴定做了总结。
2. 材料
2.1 仪器设备
( 1 ) 串连质谱:离子讲串联质谱仪 Thermo LCQ DecaXP Plus (Thermo Electron,Sanjose, CA ) 。
( 2 ) 纳喷雾离子源:美国亚利桑那大学 Chemistry Department Machine Shop 制造,也可用 Thermo Electron,New Objectives 公司(Woburn, MA) , 或者 Brechbuehler 公司(Houston,TX ) 的商业产品。
( 3 ) Surveyor 自动进样器(Thermo Electron 公司)。
( 4 ) Surveyor 微管径高效液相色谱(Thermo Electron 公司)。
( 5 ) P2000 激光加热型微电极拉制仪(Sutter Instrument 公司,Novato, CA ) 。
( 6 ) 氦压柱填充室(Brechbuehler 公司,Houston, TX ) 。
( 7 ) 特氟隆管压力室,1/16 英寸至 0.4 mm ( Chromatography Research Supplies 公司,Louisville, KY)。
( 8 ) SpeedVac 真空干燥浓缩机(Savant Instruments 公司,Farmingdale,NY ) 。
( 9 ) 旋涡振荡仪(Barnstead 公司,Dubuque,IA ) 。
2.2 HPLC 缓冲液和柱子装填材料
( 1 ) 缓冲液 A : 0.1% 甲酸( 98%~100%,EMDChemical, Gibbstown, NJ) 。
( 2 ) 缓冲液 B : 乙腈,0.1% 甲酸。
( 3 ) 缓冲液 C : 95% 250 mmol/L 乙酸铵,5% 乙腈,0.1% 甲酸。
( 4 ) 缓冲液 D : 95% 1.5 mmol/L 乙酸铵,5% 乙腈,0.1% 甲酸。
( 5 ) 溶融石英:100 μm ID X 360 μm OD ( Polymicro Technologies, Phoenix, AZ ) 。
( 6 ) 反相装填材料:Zorbax Eclipse XDB- C18 5 μm ( Agilent Technologies, PaloAlto , CA )。
( 7 ) 阳离子交换装填材料:Poly SulfoethylA ( PolyLC 公司, Columbia, MD) 。
( 8 ) C18 Sep-Pak 固相抽提柱(Waters, Bedford公司, MA) ,一只 10 ml —次性塑料注射器。
( 9 ) 9Spec-Plus PT C18 固相移液器吸头(Varian公司, LakeForest, CA ) 。
2.3 化学试剂、缓冲液、溶液和酶
( 1 ) Milli-Q 水(18 MΩ 电阻)。
( 2 ) 叶片重悬液:用丙酮配制 10% 三氯乙酸(TCA ) ,0.07% (V/V ) 巯基乙醇。
( 3 ) EDTA 漂洗液:用丙酮配制 0.07% (V/V ) 巯基乙醇(Sigma, St. Louis,MO),2 mmol/L EDTA ( Sigma, St. Louis, MO)。
( 4 ) HPLC 级乙腈(EMD Chemical) 。
( 5 ) HPLC 级甲醇(EMD Chemical) 。
( 6 ) 用水配制 0.1% 甲酸溶液。
( 7 ) 用 90% 乙腈配制 0.1% 甲酸溶液。
( 8 ) 100 mmol/L 碳酸氢铵溶液。
( 9 ) 100 mmol/L 氯化钙溶液。
( 10 ) Proteomics 级的胰蛋白酶(Sigma:10 mmol/L 盐酸配制浓度为:1 μg/μl ) 。
( 11 ) 内切赖氨酸-C蛋白酶(Roche Diagnostics, Indianapolis, IN ):10 mmol/L 盐酸中配制 0.2 μg/μl。
( 12 ) 乙醇(EMD Chemical) 。
( 13 ) 三氯乙酸(EMD Chemical) 。
( 14 ) 丙酮(EMD Chemical) 。
( 15 ) 尿素(Bio-Rad,Hercules,CA )。
4. 注释
( 1 ) 这个洗涤步骤对于解决由于 TCA 残留而引起的抽提蛋白混合物 pH 过低问题是很有必要的。因为蛋白酶在酸性 pH 下不能发挥最佳功能,所以残留的酸会带来不好的实验结果。
( 2 ) 用标准蛋白定量方法检测抽提蛋白样品的蛋白质浓度。当抽提的蛋白样品浓度过低时,可将多次抽提样品经 TCA/丙酮沉淀后汇总在一起,然后进行蛋白质定量分析。
( 3 ) 虽然胰蛋白酶在 8 mol/L 尿素中无活性,但胞内蛋白酶赖氨酸-C 在该条件下依然有活性,该步骤是可选步骤,选择该步骤的理由是,经由赖氨酸-C 消化有助于去除某些 3D 结构,有利于下一步的胰蛋白酶消化作用。
( 4 ) Spec-plus C18 吸头中的液体可在重力作用下流动,但经常会留下一半的液体。在这个吸头上连接一个 3 ml 塑料注射器施以很低的压力,就可以重新恢复流动。
( 5 ) 这步不需要自动进样器,但是我们实验室的仪器系统配置了自动进样器。样品也可以使用手动注射器或直接通过压力室打进双相层析柱中。
( 6 ) 初始 C18 梯度常常含有大量的样品,特别是那些复杂的蛋白质混合物。如果这种情况发生,将 5%~50% 的 B 梯度分离时间延长至 90~120 min,比本文介绍的 60 min 梯度分离,可明显增加更多的蛋白质鉴定数量。
参考文献
1. Link, A. J., Eng, J., Schieltz, D. M., et al. (1999) Direct analysis of protein complexes using mass spectrometry. N a t. B io te c h n o l. 17, 676-682.
2. Washburn, M . P., Wolters, D., and Yates, J. R. Ill (2001) Large-scale analysis ofthe yeast proteome by multidimensional protein identification technology. N a t.B io te c h n o l. 19, 242-247.
3. Haynes, P. A. and Yates, J. R. Ill (2000) Proteome profiling-pitfalls and progress.Y e a s t 17, 81-87.
4. Opiteck, G. J. and Jorgenson, J. W . (1997) Two-dimensional S E C / R P L C coupledto mass spectrometry for the analysis of peptides. A n a l. Ch em . 69, 2283-2291.
5. Opiteck, G. J., Lewis, K. C., Jorgenson, J. W., and Anderegg, R. J. (1997) Comprehensive on-line L C / L C / M S of proteins. A n a l. C h em . 69, 1518-1524.
6. Washburn, M . P., Ulaszek, R., Deciu, C., Schieltz, D. M., and Yates, J. R. Ill(2002) Analysis of quantitative proteomic data generated via multidimensionalprotein identification technology. A n a l. C h em .74, 1650-1657.
7. W u , C. C., MacCoss, M . J., Howell, K. E., Matthews, D. E., and Yates, J. R. 3rd(2004) Metabolic labeling of m a m m a l i a n organisms with stable isotopes for quantitative proteomic analysis. A n a l. C h em .76, 4951— 4959.
8. Froehlich, J. E., Wilkerson, C. G., Ray, W . K., et al. (2003) Proteomic study of theArabidopsis thaliana chloroplastic envelope m e m b r a n e utilizing alternatives totraditional two-dimensional electrophoresis. J. P r o te o m e R es. 2, 413-425.
9. Andon, N. L., Hollingworth, S., Koller, A., Greenland, A. J., Yates, J. R. Ill, andHaynes, P. A. (2002) Proteomic characterization of wheat amyloplasts using identification of proteins by tandem mass spectrometry. P r o te o m ic s 2, 1156-1168.
10. Peltier, J. B., Ytterberg, A. J., Sun, Q., and van Wijk, K. J. (2004) N e w functionsof the thylakoid m e m b r a n e proteome of A r a b id o p s is th a lia n a revealed by asimple, fast, and versatile fractionation strategy. J. B io l. Ch em . 279, 49367-4983.
11. Heinemeyer, J., Eubel, H., W e h m h o n e r , D., Jansch, L., and Braun, H. P. (2004)Proteomic approach to characterize the supramolecular organization of photosystems in higher plants. P h y to c h e m is tr y 65, 1683-1692.
12. Koller, A., Washburn, M . P., Lange, B. M., et al. (2002) Proteomic survey ofmetabolic pathways in rice. P ro c. N a tl. A c a d . S ci. U SA 99, 11969-11974.
13. Chen, M., Presting, G., Barbazuk, W . B., et al. (2002) A n integrated physical andgenetic m a p of the rice genome. P la n t C e ll 14, 537-545.
14. Yu, J., Hu, S., W a n g , J., et al. (2002) A draft sequence of the rice g e n o m e (O r yzas a tiv a L. ssp. indica). S c ie n c e 296, 79-92.
15. Goff, S. A., Ricke, D., Lan, T. H., et al. (2002) A draft sequence of the rice g e n o m e( O r yz a s a tiv a L. ssp. japonica). S c ie n c e 296, 92-100.
16. Initiative, A. G. (2000) Analysis of the g e n o m e sequence of the flowering plantA r a b id o p s is th a lia n a . N a tu r e 408, 796-815.
17. Salanoubat, M., Lemcke, K., Rieger, M., et al.. (2000) Sequence and analysis ofc h r o m o s o m e 3 of the plant A r a b id o p s is th a lia n a . N a tu r e 408, 820-822.
18. Tabata, S., Kaneko, T., Nakamura, Y., et al. (2000) Sequence and analysis ofc h r o m o s o m e 5 of the plant A r a b id o p s is th a lia n a . N a tu r e 408, 823-826.
19. Lunde, C. F., Morrow, D. J., Roy, L. M., and Walbot, V. (2003) Progress in maizegene discovery: a project update. F u n d . I n te g r . G e n o m ic s 3, 25-32.
20. Damerval, C., de Vienne, D., Zivy, M., and Thiellement, H. (1986) Technicalimprovements in two-dimensional electrophoresis increase the level of geneticvariation detected in wheat-seedling proteins. E le c tr o p h o r e s is 7, 52— 54.
21. Porubleva, L., Vander Velden, K., Kothari, S., Oliver, D. J., and Chitnis, P. R.(2001) T h e proteome of maize leaves: use of gene sequences and expressedsequence tag data for identification of proteins with peptide mass fingerprints.E le c tr o p h o r e s is 22, 1724-1738.
22. Zuo, X., Echan, L., Hembach, P., et al. (2001) Towards global analysis of mammalian proteomes using sample prefractionation prior to narrow p H range two-dimensional gels and using one-dimensional gels for insoluble and large proteins.E le c tr o p h o r e s is 22, 1603-1615.
23. Blonder, J., Hale, M . L., Lucas, D. A., et al. (2004) Proteomic analysis of detergent-resistant m e m b r a n e rafts. E le c tr o p h o r e s is 25, 1307-1318.
24. Guina, T., W u , M., Miller, S. I., et al. (2003) Proteomic analysis of P s e u d o m o n a sa e r u g in o s a grown under m a g n e s i u m limitation. J. A m . S o c. M a s s S p e c tr o m . 14,742-751.
25. Gatlin, C. L., Kleemann, G. R., Hays, L. G., Link, A. J., and Yates, J. R. 3rd(1998) Protein identification at the low femtomole level from silver-stained gelsusing a n e w fritless electrospray interface for liquid chromatography-microsprayand nanospray mass spectrometry. A n a l. B io c h e m . 263, 93-101.
26. Eng, J., M c C o r m a c k , A. L., and Yates, J. R. Ill (1994) A n approach to correlatetandem mass spectral data of peptides with amino acid sequences in a proteindatabase. J. A m . M a s s S p e c tr o m . 5, 976-989.
27. Yates, J. R. Ill, Eng, J. K., M c C o r m a c k , A. L., and Schieltz, D. (1995) A methodto correlate tandem mass spectra of modified peptides to amino acid sequences inthe protein database. A n a l. C h em . 67, 1426-1436.
28. Perkins, D. N., Pappin, D. J., Creasy, D. M., and Cottrell, J. S. (1999) Probability-based protein identification by searching sequence databases using mass spectrometry data. E le c tr o p h o r e s is 20, 3551-3567.
29. Creasy, D. M . and Cottrell, J. S. (2002) Error tolerant searching of uninterpretedtandem mass spectrometry data. P r o te o m ic s 2, 1426-1434.
30. Craig, R. and Beavis, R. C. (2003) A method for reducing the time required tomatch protein sequences with tandem mass spectra. R a p id C o m m u n . M a s sS p e c tr o m . 17, 2310-2316.
31. Craig, R. and Beavis, R. C. (2004) T A N D E M : matching proteins with tandemmass spectra. B io in fo r m a tic s 20, 1466-1467.
32. Nesvizhskii, A. I., Keller, A., Kolker, E., and Aebersold, R. (2003) A statisticalmodel for identifying proteins by tandem mass spectrometry. A n a l. C h em . 75,4 6 4 6 4 6 5 8 .
33. Sadygov, R. G., Liu, H., and Yates, J. R. (2004) Statistical models for proteinvalidation using tandem mass spectral data and protein amino acid sequence databases. A n a l. Ch em . 76, 1664-1671.
34. Peng, J., Elias, J. E., Thoreen, C. C., Licklider, L. J., and Gygi, S. P. (2003)Evaluation of multidimensional chromatography coupled with tandem massspectrometry ( L C / L C - M S / M S ) for large-scale protein analysis: the yeastproteome. J. P r o te o m e R es . 2 , 43-50.
35. Elias, J. E., Gibbons, F. D., King, O. D., Roth, F. P., and Gygi, S. P. (2004) Intensity-based protein identification by machine learning from a library of tandemmass spectra. N a t. B io te c h n o l. 22, 214-219.
36. Breci, L., Hattrup, E., Keeler, M., Letarte, J., Johnson, R., and Haynes, P. A.(2005) Comprehensive proteomics in yeast using chromatographic fractionation,gas phase fractionation, protein gel electrophoresis, and isoelectric focusing.P r o te o m ic s 5, 2018-2028.
37. Hall, N., Karras, M., Raine, J. D., et al. (2005) A comprehensive survey of thePlasmodium life cycle by genomic, transcriptomic, and proteomic analyses. Science 307 , 82-86.
38. Vitali, B., Wasinger, V., Brigidi, P., and Guilhaus, M . (2005) A proteomic viewof B ifid o b a c te r iu m in fa n tis generated by multi-dimensional chromatographycoupled with tandem mass spectrometry. P r o te o m ic s 5, 1859-1867.
39. Durr, E., Yu, J., Krasinska, K. M., et al. (2004) Direct proteomic mapping of thelung microvascular endothelial cell surface in vivo and in cell culture. N a t.B io te c h n o l. 22, 985— 992.