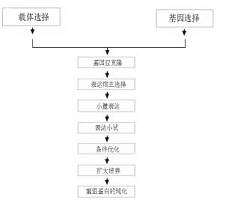
免疫亲和纯化技术
互联网
1. 将抗体结合到蛋白A或蛋白G微珠上。对于一般用途的层析柱,每毫升湿的微珠大约可以结合2mg单克隆抗体或亲和纯化的多克隆抗体。将抗体和蛋白A或蛋白G微珠混合制成稀薄的匀浆,在总量为10ml的溶液中加入大约lml微珠,室温孵育1h,轻轻摇动混匀。
2. 用10倍体积的0.2mol/L硼酸钠(pH9.0)洗涤微珠2次,每次以3000g离心2rain或10 000g离心30s。
3. 用10倍体积的0.2mol/L硼酸钠(pH9.0)重悬微珠,留取相当于10t~l湿微珠的样品。加入足量的二甲基庚二酸酯固体.至微珠匀浆中,使终浓度为20mmol/L。
4. 室温孵育30min,并轻轻混匀。留取相当于10t~l偶联微珠的样品。
5. 用0.2mol/L乙醇胺pH8.0.洗涤微珠1次以终止反应。然后重悬于0。2mol/L乙醇胺,室温孵育2h,轻轻混匀。微珠用PBS洗涤后,重悬于PBS,加入硫柳汞保存。
6. 将偶联前和偶联后的微珠样品加入Laemmli样品缓冲液中煮沸后,检查偶联效果。分别取相当于1ul和9ul 2份样品在10% SDS —聚丙烯酰胺凝胶中电泳,并用考马斯亮蓝染色,偶联效果良好时,在偶联前的微珠样品中显示一条55kDa的重链带,而偶联后的样品无此区带。
7. 将 抗体 包被的微珠转入合适的层析柱中,用PBS冲洗容器,收集残留的微珠。如果可能,仅使用结合制品中全部抗原所需的 抗体 微珠基质。
8. 用20倍柱床体积与制备抗原相同的 缓冲液 洗柱。
9. 将抗原液加到柱上,按每毫升柱体积大约lml/h的速度使抗原溶液流过层析柱,可以用一台蠕动泵控制。
10. 用20倍柱床体积的结合 缓冲液 (PBS)洗柱。
11. 用20倍柱床体积的预洗脱缓冲液洗柱,建议使用预洗脱缓冲液。
12. 采用分段洗脱法,连续以0.5倍柱床体积的洗脱缓冲液通过层析柱,分管收集每一组分。如果用过高或过低pH值的缓冲液洗脱,收集管内需加入0.1倍柱床体积的缓冲液。
13. 检测每管的抗原含量,将浓度高的各管合并。根据抗原的用途,需对获得的蛋白洗脱液透析以改变缓冲液。