基因组编辑技术应用于作物遗传改良的基本原则及进展(下篇)
上海迈其
1. 基因组编辑技术应用于作物改良的基本原则
1.1 ZFNs、TALENs 和 CRISPR/Cas 如何抉择
ZFNs、TALENs 和 CRISPR/Cas 都是有效的基因组编辑技术,但三者在设计、特异性和效率上各有不同。ZFNs 由于特异性不高、脱靶问题严重及获得 ZFN 蛋白非常困难,严重阻碍了其广泛应用。TALENs 的优点是特异高、脱靶效应低,但载体构建较繁琐、编辑效率不是很高、且难以同时对多个基因进行编辑。CRISPR/Cas 系统的优点是编辑效率非常高,设计和构建极其简单 (只需 2—3d),仅需设计、合成靶点识别序列,且也只需将 sgRNA 串联就能实现多基因编辑;但 CRISPR/Cas 系统的特异性稍差,存在较明显的脱靶效应,另受 PAM 识别位点限制。目前,ZFNs 已基本被 TALENs 和 CRISPR/Cas 系统所取代,而 TALENs 在植物基因组编辑中也已逐渐失去优势。因此,在作物遗传改良上,优先推荐使用 CRISPR/Cas 系统,如 CRISPR/Cas 系统无合适的靶位点或对特异性要求极高的情况下可使用 TALENs 技术。
1.2 基因敲除还是基因替换
目前,基因编辑技术应用于作物遗传改良主要有两种方式,一是通过靶向敲除目标性状负调控基因,造成该基因功能缺失,以改良目标性状;二是通过对目标性状控制基因进行定点替换,导致该基因功能发生改变,从而获得新的目标性状。因此,在实践中运用基因组编辑技术对作物进行遗传改良时也要分以下 2 种情况:一是对于目标性状起负调控作用的基因采取基因敲除的方式,目前,绝大部分基于基因组编辑技术的作物遗传改良都是通过此方式实现的,如 WANG 等对水稻稻瘟病抗性的改良、ZHOU 等创制水稻温敏核雄性不育系等;二是对于目标性状的获得是因目标基因突变导致基因功能发生改变的基因,采用基因定点替换的方式,如抗除草剂水稻、玉米等都是通过基因定点替换而获得的。
1.3 靶位点如何选择
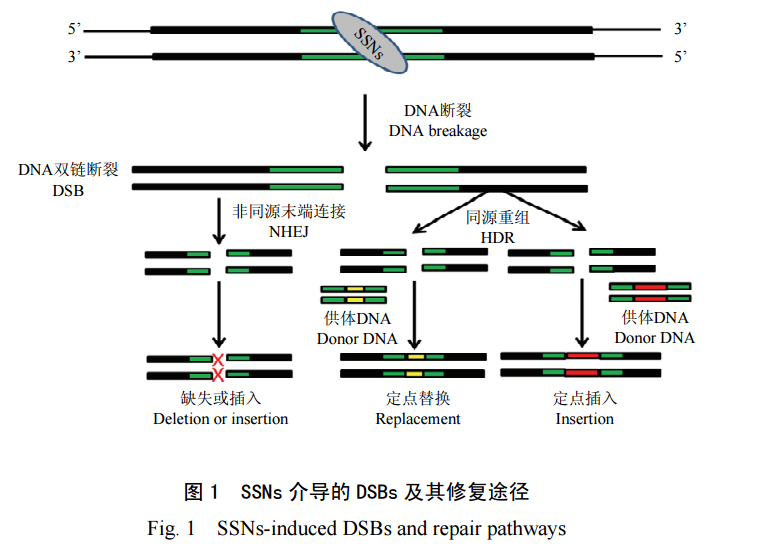
目前,已有多个专门设计 SSNs 靶位点和搜索脱靶位点的网站和工具。而在作物遗传改良的实际操作中,是敲除多基因还是单基因、靶位点在基因上的位置及数目都是需要考虑的。如果需要同时改良多个目标性状,以及目标性状是由微效多基因或多等位基因控制的情况,最好针对每个目标性状控制基因,或微效多基因等设计多个靶位点进行定向敲除,能最快、最省地获得改良目标性状;而如果控制目标性状的是主效基因,则敲除单个基因一般即可达到改良目的。
靶位点在基因上的位置也比较重要,进行基因敲除时,靶位点应优先选择在起始密码子附近,或在特定的功能域 (可能引起密码子缺失和移码);而如果是基因替换,靶位点则需选择在基因特定功能区 (突变后基因功能发生改变的区域)。此外,靶位点的数量也关系到定向编辑的效率和遗传转化的规模,笔者在试验中发现,敲除同一个基因时分别设计 1 个、2 个和 3 个靶点进行修饰,突变的效率分别为 42%、70%(2 个靶点都突变的为 63.3%) 和 90%(3 个靶点都突变),获得纯合突变株的效率分别为 14.3%、47.6% 和 40.7%。因此,在基因敲除时,建议单个基因设计 2 个靶位点,能减轻遗传转化的工作量,也能更省、更快地获得纯合突变植株,极大地节省人力和物力。
1.4 如何快速获得纯合的 DNA-free 编辑植株
目前,获得纯合的 DNA-free 编辑植株主要有 2 种途径:一是通过经典的 TALENs 和 CRISPR/Cas9 技术获得基因得以修饰的植株后,通过自交或杂交的方式剔除外源基因;二是直接利用 DNA-free 植物基因组编辑系统对植物基因组进行定向编辑。2 种途径都有各自的优缺点,通过自交或杂交剔除的途径相对来说操作简单、成本低,普通的分子实验室都能操作完成,且最快能在 T1 代获得纯合的 DNA-free 编辑植株。DNA-free 植物基因组编辑系统的优势在于能得到全程无外源 DNA 整合的编辑植株,且在 T0 代即可获得纯合的 DNA-free 编辑植株,但相对经典的 CRISPR/Cas9 系统操作较复杂、成本更高。因此,想要最快获得纯合的 DNA-free 编辑植株,有条件的实验室优先推荐使用 RGENRNPs 编辑系统,其次推荐瞬时表达 CRISPR/Cas9 编辑系统中的 TECCRNA 方式,而 TECCDNA 方式因质粒 DNA 被细胞内源核酸酶分解后的小片段 DNA 有时会插入靶位点和非靶位点处,如果插入的 DNA 片段过小,目前的检测手段还不能对其进行有效鉴定,故不推荐;没有条件利用 DNA-free 植物基因组编辑系统的情况下,则使用经典的 CRISPR/Cas 系统。
2. 基因组编辑技术在作物遗传改良上应用的机遇与挑战
作物转基因育种的历史已有 20 多年,很多转基因作物如棉花、大豆、玉米等已在多个国家种植,但转基因生物 (geneticallymodifiedorganism,GMO) 的生物安全性问题一直备受关注。基因编辑技术的出现为作物分子育种提供了新的机遇,但仍然面临政策法规和技术优化两方面的挑战。目前,国际上对基因编辑作物是否属于转基因生物尚未有明确一致的定论,其监管标准也存在较大争议。美国农业监管部门认为基因编辑作物 (genomeeditedcrop,GEC) 是通过细胞自我修复机制而产生的突变体,与作物自然突变以及物理和化学诱导突变极其相似,都是少数几个核苷酸的改变,因此,GEC 不被定义为 GMO。欧盟对 GMO 监管较为严格,其认为只要有外源 DNA 转入,而不论最终植物中是否还存在外源 DNA,都被定义为 GMO。从科学角度来讲,基因编辑诱导的突变与自然突变以及物理和化学诱导突变性质一样,实质无法区分,因此欧盟也有建议将 GEC 定义为非 GMO。但基于政治考虑,欧盟尚未下明确定论,对 GEC 的监管标准存在不确定性。目前,中国对于基因编辑作物的监管标准尚无明确的规定,因此亟需出台相关的政策法规以正确引导基因编辑育种。迄今,美国农业监管部门至少已认定 5 种基因编辑作物新品种不属于 GMO 范畴,即通过 ZFNs 技术创制的低植酸玉米品种,通过 TALEN 技术创制的耐冷藏马铃薯品种和高油酸、低亚油酸大豆,以及通过 CRISPR/Cas9 技术创制的抗褐化双孢菇和抗除草剂玉米。
为正确引导基因编辑技术应用于作物育种,中国科学院的李家洋院士等针对基因编辑作物提出了一个监管框架,并发表在《NatureGenetics》杂志。文章对基因编辑作物的监管提出了几点建议:一是在研究阶段应尽量减少 GEC 不受控的传播风险;二是要确保 GEC 中外源 DNA 被完全剔除;三是准确记录靶点 DNA 的变化,如果通过同源同组引入了新的序列,必须注明供体和受体之间的亲缘关系;四是基于参考基因组信息和全基因组测序技术检测并确定主要靶点没有意外的二次编辑事件和考虑潜在脱靶事件的后果;五是将上述四点信息在新品种资料中登记备案,除上述四点外,GEC 只需执行常规作物品种的监管标准即可。同期,该杂志编辑部发文支持 GEC 管理框架的建议,并倡导 GEC 品种在完成透明的原则下,不需要进一步的监管,及与传统品种进行区分。
基因组编辑技术从出现至今不过短短十多年时间,但其已广泛应用于生物医学和农业等领域。特别是 TALENs 和 CRISPR/Cas9 技术出现后,极大地加快了作物分子育种的研究步伐。目前,CRISPR/Cas 技术已成为基因编辑应用的首要选择,虽然发明至今不到 5 年时间,但已被广泛应用于生物和农业的各个领域,而其本身也历经了多次技术优化。例如,利用 Cas9 变体将脱靶率降低到检测不到的水平,对 Cas9 和 Cpf1 蛋白进行定点突变扩大了 PAM 位点的选择范围,基于 CRISPR/Cas9 的植物基因组单碱基编辑系统,基于 CRISPR/Cas9 的植物基因组定点插入和替换系统,以及 DNA-free 植物基因组编辑系统等。
目前,基因编辑技术应用于作物遗传改良,主要是通过定点突变靶标基因,造成基因功能缺失 (loss-of-function) 以实现性状改良,故敲除的基因必须都是目标性状负调控基因。但作物许多性状改良都需要获得基因功能 (gain-of-function),因此,基因组定点替换或插入的基因组编辑具有更广泛的应用前景,而植物细胞中同源重组效率很低,目前植物基因组编辑技术对基因单碱基替换、片段定点插入和替换等编辑的效率还很低。如目前已报道的植物单碱基定点替换技术在水稻、小麦和玉米中的编辑效率为 0.39%—20%(大都低于 10%),且只能是 C→T(G→A) 碱基替换;而已报道的植物基因组定点插入和替换技术在水稻、玉米和拟南芥中的编辑效率也极低,片段定点替换效率普遍低于 1%。因此,对大部分控制重要农艺性状的正调控基因目前还无法高效、精准地进行编辑,从而极大地限制了基因编辑技术大规模应用于作物遗传改良的步伐。
虽然目前基因组编辑技术应用于作物遗传改良还存在政策法规和技术优化两方面的挑战,但在植物基因功能研究和作物遗传改良上其更具有其他分子技术无法比拟的巨大优势和机遇。放眼未来,我们预计 GEC 品种监管的法规肯定会宽松;实现基因定点替换和插入的基因组编辑技术一定会得到优化。随着大量作物品种全基因组测序的完成和越来越多重要农艺性状不利基因被发现,基因组编辑技术必将在作物遗传改良和品种培育上发挥巨大的作用。
基因组编辑技术应用于作物遗传改良的进展(上篇)
来源:《中国农业科学》 2018,51(1):1-16