安全又高效的多糖纯化方法
Cytiva(思拓凡)
5672
多糖(Polysacharides, PS),由20个以上的单糖以糖苷键相连组成的聚合物。通常具有调节机体免疫、抗菌抗病毒、抗肿瘤的作用,研究广泛。按照其来源来分,有动物多糖如肝素等,植物多糖如大黄多糖、枸杞多糖等,还有细菌荚膜多糖等。现行的多糖提取方法多采用酸碱醇沉、有机试剂抽提的方法,操作复杂,并有些试剂具有很强的毒性给操作者的健康带来威胁,对环境具有严重危害,其残留也影响制品的质量,并且有机试剂抽提的方法也不适合大规模工业化生产操作,更为安全高效的纯化方法显得尤为重要,因为多糖种类繁多,下文我会就两个研究重点植物多糖和多糖疫苗(以流脑多糖)为例进行详细介绍:
1. 植物多糖
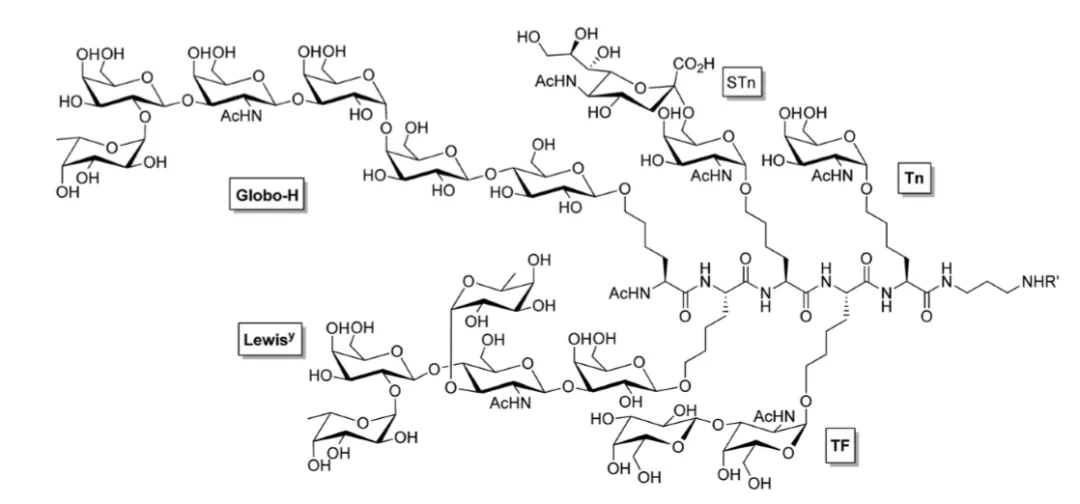
植物多糖具有调节增强机体免疫、功能从而起到抗肿瘤、抗菌抗病毒的作用,如香菇多糖、灵芝多糖、人参多糖等。植物中成分复杂、需要综合使用多种分离纯化技术才能分离出高纯度的单一多糖成分。在多糖的分离纯化中可使用离子交换层析、凝胶过滤层析技术进行分离,其纯化路线如下:

2. 流脑多糖
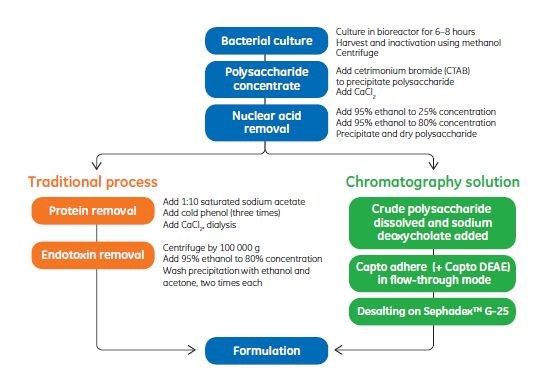
流脑球菌的荚膜多糖是引起免疫反应的主要抗原物质。现行的A、C、W、Y 群流脑疫苗均是提取菌体的荚膜多糖作为抗原制备的,在提取多糖的同时需要尽可能多地去除菌体的蛋白,以减少疫苗的副反应,现行的疫苗制造工艺均采用十六烷基三甲基溴化铵沉淀多糖,加入乙醇沉淀去除核酸以及回收多糖,得到粗制多糖。粗制多糖溶解后加入苯酚使蛋白变性析出,根据粗制多糖中含有的蛋白的情况,此步骤通常需要重复一至三次。苯酚具有很强的毒性给生产操作者的健康带来威胁,对环境具有严重危害,其残留也影响制品的质量,并且苯酚抽提的方法也不适合大规模工业化生产操作。因此GE 公司开发用层析的方法分离多糖与蛋白,避免使用苯酚,得到精糖的蛋白含量小于1%,核酸等杂质合格,多糖回收率大于58%,这一工艺的开发造福社会同时为用户带来安全高效的纯化方案。
将粗糖通过Capto adhere 和Capto DEAE 两种层析介质串联,流穿模式进行分离纯化的。Capto 骨架的介质具有很好的刚性和载量,对于多糖这样大分子的物质仍然有很好的通量。Adhere 是复合模式的配基,同时具有弱阴离子交换与疏水作用, DEAE则是弱阴离子交换层析填料。
下面是流脑多糖的纯化路线图:
通过层析图206nm 和A280nm 吸收可以看出通过层析纯化可以将多糖与蛋白分开,达到多糖与蛋白核酸的分离作用,对多糖起到纯化效果。
Columns: Serially connected Capto adhere XK16/20 and Capto DEAE XK 16/10 columns
Sample: Ethanol precipitated polysaccharide A (2.5 mg/mL)
Buffer: 20 mmol/L Tris-HCl, pH 8.0 + 1% SDC
System: ÄKTA avant 150
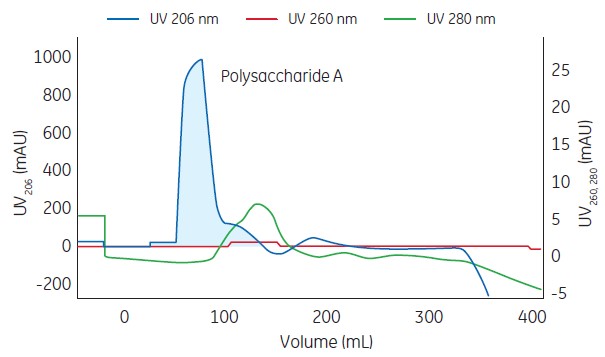
Fig 1. Chromatogram of polysaccharide of serogroup A after purification on Capto Adhere and Capto DEAE resins.
Columns: Serially connected Capto adhere XK16/20 and Capto DEAE XK 16/10 columns
Sample: Ethanol precipitated polysaccharide C (2.5 mg/mL)
Buffer: 20 mmol/L Tris-HCl, pH 8.0 + 1% SDC
System: ÄKTA avant 150
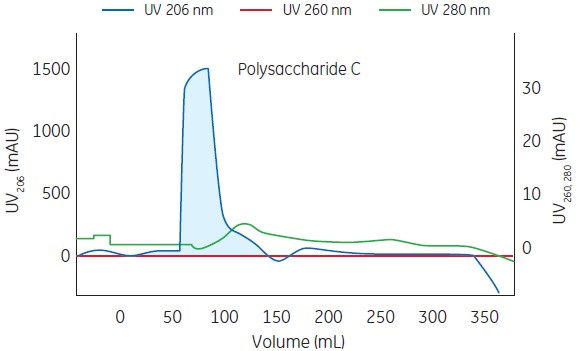
Fig 2. Chromatogram of polysaccharide of serogroup C after purification on Capto Adhere and Capto DEAE resins.
Columns: Serially connected Capto adhere XK16/20 and Capto DEAE XK 16/10 columns
Sample: Ethanol precipitated polysaccharide W135 (2.5 mg/mL)
Buffer: 20 mmol/L Tris-HCl, pH 8.0 + 1% SDC
System: ÄKTA avant 150
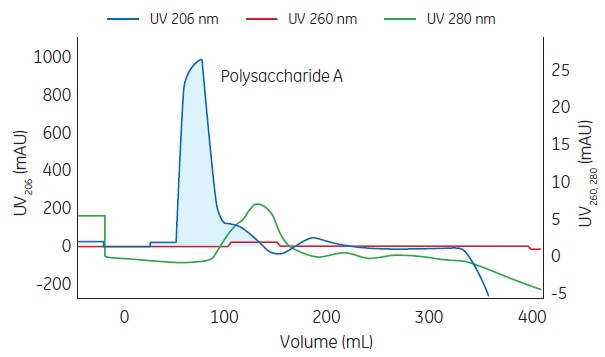
Fig 3. Chromatogram of polysaccharide of serogroup W135 after purification on Capto Adhere and Capto DEAE resins.
Columns: Serially connected Capto adhere XK16/20 and Capto DEAE XK 16/10 columns
Sample: Ethanol precipitated polysaccharide Y (2.5 mg/mL)
Buffer: 20 mmol/L Tris-HCl, pH 8.0 + 1% SDC
System: ÄKTA avant 150

Fig 4. Chromatogram of polysaccharide of serogroup Y after purification on Capto Adhere and Capto DEAE resins.
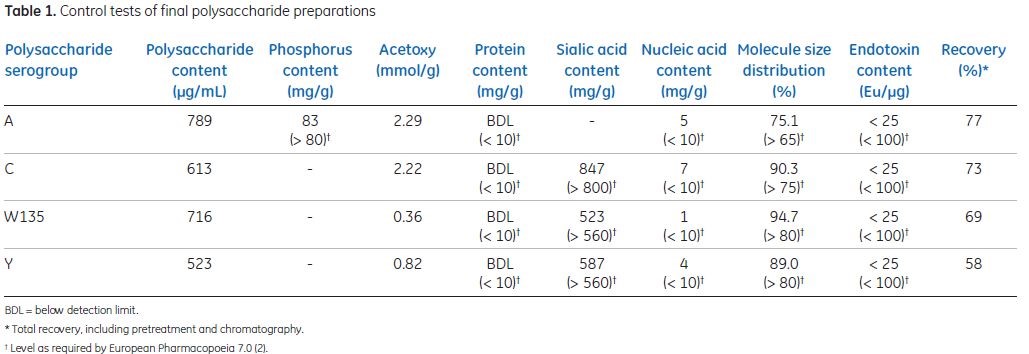
最终A,C,W135,Y的收率分别为77%, 73%, 68%, and 58%,质量及杂质残留符合欧洲药典,具体见下表table1,此层析工艺易放大,并可以应用于其它多糖纯化。
1. 植物多糖
植物多糖具有调节增强机体免疫、功能从而起到抗肿瘤、抗菌抗病毒的作用,如香菇多糖、灵芝多糖、人参多糖等。植物中成分复杂、需要综合使用多种分离纯化技术才能分离出高纯度的单一多糖成分。在多糖的分离纯化中可使用离子交换层析、凝胶过滤层析技术进行分离,其纯化路线如下:

2. 流脑多糖
流脑球菌的荚膜多糖是引起免疫反应的主要抗原物质。现行的A、C、W、Y 群流脑疫苗均是提取菌体的荚膜多糖作为抗原制备的,在提取多糖的同时需要尽可能多地去除菌体的蛋白,以减少疫苗的副反应,现行的疫苗制造工艺均采用十六烷基三甲基溴化铵沉淀多糖,加入乙醇沉淀去除核酸以及回收多糖,得到粗制多糖。粗制多糖溶解后加入苯酚使蛋白变性析出,根据粗制多糖中含有的蛋白的情况,此步骤通常需要重复一至三次。苯酚具有很强的毒性给生产操作者的健康带来威胁,对环境具有严重危害,其残留也影响制品的质量,并且苯酚抽提的方法也不适合大规模工业化生产操作。因此GE 公司开发用层析的方法分离多糖与蛋白,避免使用苯酚,得到精糖的蛋白含量小于1%,核酸等杂质合格,多糖回收率大于58%,这一工艺的开发造福社会同时为用户带来安全高效的纯化方案。
将粗糖通过Capto adhere 和Capto DEAE 两种层析介质串联,流穿模式进行分离纯化的。Capto 骨架的介质具有很好的刚性和载量,对于多糖这样大分子的物质仍然有很好的通量。Adhere 是复合模式的配基,同时具有弱阴离子交换与疏水作用, DEAE则是弱阴离子交换层析填料。
下面是流脑多糖的纯化路线图:

通过层析图206nm 和A280nm 吸收可以看出通过层析纯化可以将多糖与蛋白分开,达到多糖与蛋白核酸的分离作用,对多糖起到纯化效果。
Columns: Serially connected Capto adhere XK16/20 and Capto DEAE XK 16/10 columns
Sample: Ethanol precipitated polysaccharide A (2.5 mg/mL)
Buffer: 20 mmol/L Tris-HCl, pH 8.0 + 1% SDC
System: ÄKTA avant 150

Fig 1. Chromatogram of polysaccharide of serogroup A after purification on Capto Adhere and Capto DEAE resins.
Columns: Serially connected Capto adhere XK16/20 and Capto DEAE XK 16/10 columns
Sample: Ethanol precipitated polysaccharide C (2.5 mg/mL)
Buffer: 20 mmol/L Tris-HCl, pH 8.0 + 1% SDC
System: ÄKTA avant 150

Fig 2. Chromatogram of polysaccharide of serogroup C after purification on Capto Adhere and Capto DEAE resins.
Columns: Serially connected Capto adhere XK16/20 and Capto DEAE XK 16/10 columns
Sample: Ethanol precipitated polysaccharide W135 (2.5 mg/mL)
Buffer: 20 mmol/L Tris-HCl, pH 8.0 + 1% SDC
System: ÄKTA avant 150

Fig 3. Chromatogram of polysaccharide of serogroup W135 after purification on Capto Adhere and Capto DEAE resins.
Columns: Serially connected Capto adhere XK16/20 and Capto DEAE XK 16/10 columns
Sample: Ethanol precipitated polysaccharide Y (2.5 mg/mL)
Buffer: 20 mmol/L Tris-HCl, pH 8.0 + 1% SDC
System: ÄKTA avant 150

Fig 4. Chromatogram of polysaccharide of serogroup Y after purification on Capto Adhere and Capto DEAE resins.
最终A,C,W135,Y的收率分别为77%, 73%, 68%, and 58%,质量及杂质残留符合欧洲药典,具体见下表table1,此层析工艺易放大,并可以应用于其它多糖纯化。