用全血直接分选 CD3+ T 细胞
德国IBA Lifesciences
免疫亲和层析是以 Fab 片段为基础的无痕亲和细胞分选技术(traceless affinity cell selection, Fab-TACS)。Fab-TACS 运用免疫亲和层析的原理,使用细胞表面抗原分子 CD marker 中的 Fab 片段来进行捕捉及释放目的细胞。以抗体的 Fab 片段取代一般具有高亲和力的完整抗体,实现试剂与细胞的可逆结合,直接从全血或其他血液样本中分选目的细胞。
Fab-TACS 柱子填充了包被有 Strep-Tactin® 多聚体的细胞级琼脂糖基质,偶联上 Strep-tag 的 Fab 片段(Fab-Streps)特异性的结合到琼脂糖基质上。随后,加入全血或其他血液制剂流过柱子。目的细胞通过特异性的 Fab-Strep 作用从而结合到琼脂糖基质上,其他非目的细胞则有效的被洗去。最后,加入生物素使目的细胞从 Fab-Streps 上解离。至此,就已分离得到不带任何标记的、真实的目的细胞可用于下游的实验研究。

1. 实验流程
所需产品:
CD3 Fab-TACS® Gravity Kit, human(IBA Lifesciences, Cat. no.: 6 - 6201 - 004),內含 :
4x Fab-TACS® Gravity column (capacity pro column: 15 ml whole blood)
1x CD3 Fab-Strep, human
1x Buffer CI (10x)
1x Biotin stock solution
1x Fab-TACS® Gravity Adapter
Fab-TACS® Flow Restrictor, Pack of 5
1.1 用 ddH2O 将 10× Buffer CI 稀释至 1×;
1.2 用 1 ml Buffer CI 溶解冻干粉的 Fab-Strep,用移液器反复吹打,不能涡旋!溶解后的 Fab-Strep 进行分装保存(可 200µl 每管),冻存于- 20°C,避免反复冻融;
1.3 往 200µl 溶解后的 Fab-Strep 中,加入 800µl 的 Buffer CI 。此时,Fab-Strep 溶液已准备好,可直接使用了;
1.4 加入 200µl 100 mM 的生物素至 20 ml Buffer CI 中,混匀;
1.5 稀释全血,全血:Buffer CI = 3:1。例如:9 ml 外周血加入 3 ml Buffer CI 进行稀释,混匀。为了移除团块,可将稀释后的全血过 40µm 的筛网;对于 PBMCs 样本,用 Buffer CI 重悬 PBMCs 至浓度为:3x108 cells/ 5 ml
1.6 移除柱子上的帽子,剪掉柱子下端。将柱子放置于 Adapter 上,让柱子中的液体流尽;
1.7 柱子中加入 5 ml 的 Buffer CI,完全流尽,下面用离心管接住;
1.8 往柱子中加入 1 ml 2.3 中准备好的 Fab-Strep,让其自动往下流(孵育时间是足够 2 分钟的);
1.9 加入2 ml Buffer CI洗柱子。更换下面接废液的离心管,至此柱子就准备好了;
1.10 将前面稀释好的血液加入柱子中,一次最多加入 5 ml(为了提高得率,可通过使用 restrictor 来降低流速),并收集血液。每根柱子能承受的全血量请参考对应的说明书
1.11 过完全血后,用 4×10 ml 的 Buffer CI 洗 4 次柱子;
1.12 更换下面接液流的离心管,收集目的细胞。加入 1 ml 2.4 中准备好的 Biotin Elution Buffer,让液流完全进入胶体后孵育 2 min,加入 9 ml 的 Biotin Elution Buffer;
1.13 对于从全血中分选目的细胞,再加入 10 ml 的 Biotin Elution Buffer;
1.14 300 g 转速离心 10 分钟,收集洗脱目的细胞。
流程图:

2. 实验数据
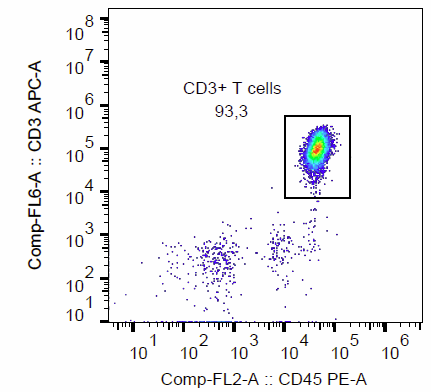
以下流式图为从 7.5 ml 全血中,选出 CD3 + T 细胞的数据。选后细胞以 CD3 -APC (OKT- 3) 及 CD45 -PE (HI30,白细胞标志) 抗体染色后,进行流式分析,死细胞以 DAPI 染色先行排除,左右分别为分选前后的细胞群分布。
|
|
|
总结:
几次实验的结果,使用 Fab-TACS® Gravity column 来从全血直接进行 CD3+ T 细胞分选,平均得率为 84.5%,纯度大于 90%,细胞存活率高于 95%,且目标细胞不含标记,贴近天然,使下游实验更精确。