PCR 常见问题解决方案全解析
诺唯赞生物
PCR 过程中免不了遇到各种问题,如扩不出目的条带、有非特异性条带、空白对照出现扩增产物、扩增产物跑胶弥散或拖尾、高保真 PCR 出现突变等等。今天师兄就带大家来聊一聊 PCR 的常见问题应该如何解决。
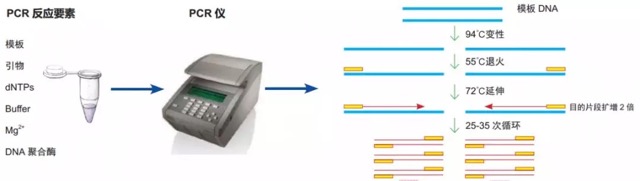
PCR 实验包括反应体系的配置和反应程序,反应体系中有模板、引物、dNTP、酶、buffer、Mg2+,反应程序又包括预变性、变性、退火、延伸和彻底延伸。那么在 PCR 出现问题时主要是从反应体系的各个组分和反应程序上来进行调节优化。
Q1: 实验组无扩增条带
A1:
(1) 引物
检查人工合成的引物是否因存储条件不当而降解(建议用新合成的引物进行尝试);引物设计是否合理,可利用BLAST检查引物特异性或重新设计引物(如果之前用过该引物,可排除引物设计问题)。
(2) 模板
长期放置、反复冻融会导致模板断裂、开环或降解,应使用新鲜制备的 DNA 双链作为模板;模板 GC 含量过高会导致 DNA 的双链无法打开,此时加入 PCR Enhancer,可以有效降低解链温度;模板为粗品,有可能是 DNA 未释放出来(若样本为植物叶片,要确保植物为非多糖多酚植物,取新鲜幼嫩的叶片,并将叶片面积剪小,如黄枪头尖部面积大小;可适当延长裂解时间)或存在抑制物(建议降低模板浓度,尝试不同稀释倍数的模板);若模板为 cDNA,要确认逆转录所用 RNA 的纯度、完整度以及逆转录所用的引物(若扩增长片段,建议使用高质量的 RNA 逆转录,逆转录时不加随机引物)。
(3) 酶
反应所用的酶因保存或运输不当而失活,建议更换新酶或用另一来源的酶重新实验。
(4) 扩增体系
反应体系配制错误,建议重复实验。
(5) 反应程序
检查变性温度是否准确,PCR 仪指示温度与实际温度是否相符,如果温度过高,酶在前几个循环就迅速失活,温度过低则模板变性不彻底;若模板为酵母菌,可将预变性时间延长 10min;退火温度不合适,可对退火温度设置梯度,摸索最佳的退火温度;如果目的片段较长,可尝试 Touch Down 程序;检查延伸时间是否充足。
(6) Mg2+ 浓度不合适
Mg2+ 浓度过低可影响PCR产量甚至使 PCR 扩增失败;Mg2+ 浓度过高会降低 PCR 的特异性,应适当调整Mg2+ 浓度。
Q2: 非特异性扩增
A2:
(1) 引物
引物设计不够优化。引物与靶序列有非特异性互补或自身聚合成二聚体,可降低引物浓度进行优化,必要时重新设计引物。
(2) 模板
模板不纯,被污染,需重新制备模板。
模板降解或过量,通过电泳检查模板完整性及浓度,必要时重新纯化模板。模板的使用量请参考说明书。
(3) 反应程序
反应程序不够优化。如果出现比目的条带小的杂带,可通过提高退火温度,降低循环数调整;如果出现比目的条带大的杂带,可缩短延伸时间、降低循环数。
(4) 酶
酶量加入过多。
Q3: 空白对照出现扩增产物
A3:
(1) 引物设计不合理。
扩增序列与非目的扩增序列有同源性,PCR 也可以扩增出非靶序列的序列。
(2) 看胶图:空白对照条带的大小是否与目的条带一样,空白对照条带的亮度是否与目的条带一样。
若扩增产物条带大小与目的条带一致,说明有污染。更换新的Mix、水或引物重复实验。反应体系在超净工作台内配制,减少气溶胶污染。空白对照条带的亮度比目的条带弱:可通过降低循环数使实验组目的条带扩出,而空白对照扩不出目的条带。
Q4:扩增产物跑胶条带弥散或拖尾
A4:
(1) 胶:制胶时要使胶完全融化。
(2) 引物:检查人工合成的引物是否因存储条件不当而降解。
(3) 模板:降解或过量,可通过电泳检查模板完整性及浓度,必要时重新制备模板。模板的使用量请参考说明书。如果目的条带较长,模板是 cDNA,要确认逆转录所用 RNA 的纯度及完整度,逆转录时不加随机引物重新逆转录。
(5) 酶:酶量加入过多。
Q5: 高保真 PCR 出现突变
A5:
(1)测序样品数量:一般来说,一个样品的测序结果不一定可靠,建议多测几个。
(2) 突变处的测序信号:检查测序信号是否可信,在测序反应的开始和最后部分测序信号不太可信。
(3) 突变的具体位置和突变类型:检查多个测序结果中突变位置是否一样,突变类型是否一样,如果都在同样的位置发生了同样的突变,则可以排除酶的原因,因为酶引起的突变是随机的,不可能总在一个位置发生突变。
(4) 模板类型:若模板是质粒,是否测过序;若模板是 cDNA,有可能是 cDNA 本身带有突变。
(5) 其他原因(模板反复冻融、模板长时间在紫外光下照射导致的模板发生突变;基因序列与 NCBI 上的不一致)。