膜蛋白大麻素受体 CB2 纯化设计思路
IBA生命科学
膜蛋白在生物体的许多生命活动中起着非常重要的作用,如细胞的增殖和分化、能量转换、信号转导及物质运输等。据估计大约有 60% 的药物作用靶点是膜蛋白。
大多数膜蛋白的含量较低, 另外用于溶解细胞膜上 GPCR 的高浓度洗涤剂进一步限制了下游的纯化方法。传统的色谱方法,如离子交换或疏水色谱,对于从稀释的含清洁剂的溶液中纯化大量蛋白质是无效的。膜蛋白的纯化仍是目前很多科研工作者遇到的难题之一。
今天,我们就跟大家分享一篇膜蛋白纯化实例。

人大麻素受体 CB2 是一种完整的膜 G 蛋白偶联受体 (GPCR),主要表达于免疫源细胞。它涉及炎症、神经退行性疾病、肥胖和疼痛等代谢途径的调节,因此也是药物开发的一个重要靶标。在本篇文章中,作者使用亲和标签开发的新纯化方案能够有效分离宿主细胞中低表达的重组 GPCR。该方法适用于制备毫克量的稳定同位素标记受体,用于高分辨率核磁共振研究。
一、实验设计思路
1、CB2 表达载体构建:为了找到最合适的标签位置,作者对 Linker 和 Twin-Strep-tag 标签位置进行了不同的设计。
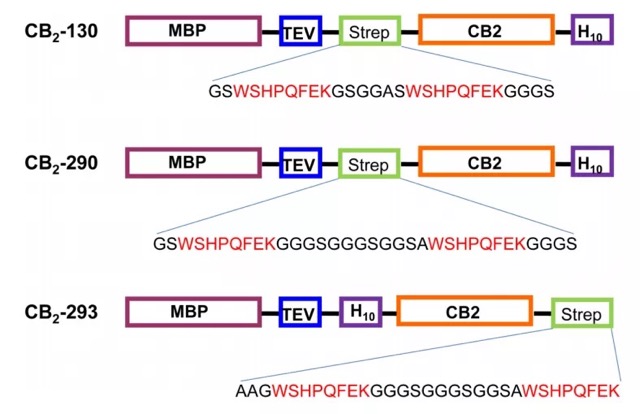
2、E.coli 系统表达 CB2 蛋白及膜蛋白制备,测定 strep-tag 对 Strep-Tactin XT的亲和力,大规模纯化 CB2 蛋白;然后通过 WB 检测 MBP-CB2 的表达情况,G 蛋白激活实验检测 CB2 的功能活性。

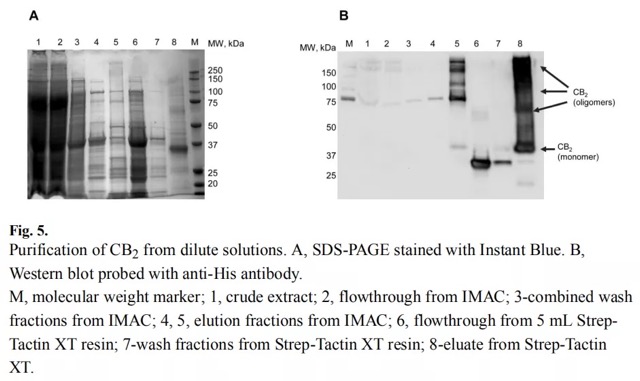
3、CB2 蛋白的纯化的策略:根据不同构建载体表达的情况及 Strep-Tactin 亲和力的测试,作者通过串联亲和层析对 CB2 蛋白进行纯化,分别使用 C 端 His10 和 N 端 twin-Strep-tag。首先使用 Ni-resin 进行第一步纯化后,再从含有 CB2 蛋白的粗提物进行透析,用 TEV 蛋白酶处理,并应用于 Strep-Tactin XT 柱上捕获目的蛋白。
二、结论
在本篇文章中,作者使用 Strep-Tactin® XT 高亲和力的填料纯化出了完整的膜蛋白受体 CB2,并开发了一种有效的能从稀释后的溶液中捕获和纯化重组大麻素受体 CB2 的方案。
另外在进行复杂蛋白纯化时,设计标签之间的 Linker 和标签的不同位置也发现,标签连接在 N 端能更有效的和填料结合。这也提示我们在进行膜蛋白纯化时,要多尝试不同的标签和设计的思路。